Раствор - сернокислый титан
Cтраница 3
Метатитановая кислота, получаемая при гидролизе растворов сернокислого титана, обладает аморфной или слабо выраженной кристаллической структурой анатаза. [31]
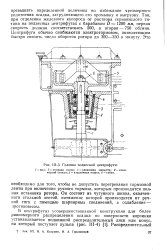 |
Головка подвесной центрифуги. [32] |
Так, при отделении железного купороса от раствора сернокислого титана на подвесных центрифугах с барабаном D 1200 мм, первая скорость должна соответствовать 500, а вторая - 750 об / мин. Центрифуги обычно снабжаются электротормозом, позволяющим быстро снизить число оборотов ротора до 300 - 350 в минуту. [33]
Известно, что существующий сернокислотный способ получения растворов сернокислого титана, пригодных для производства пигментной двуокиси титана, сложен и многостадиен. [34]
Описанные выше операции, связанные с получением растворов сернокислого титана, последовательность их проведения, а также данные по составу растворов являются наиболее общими и характерными в производстве двуокиси титана. [35]
По некоторым данным, рекомендуется добавление к раствору сернокислого титана не только бланфикса, но и некоторого количества осажденного сернокислого кальция, который более способствует гидролизу, чем бланфикс. После гидролиза осадок промывают и прокаливают; при промывке из осадка удаляется сернокислый кальций. [36]
Титр приготовленного по одному из указанных выше способов раствора сернокислого титана окончательно устанавливают весовым методом. Для этого отбирают пипеткой две порции раствора по 50 мл в стаканы емк 200 мл, разбавляют водой до 100 мл, нагревают до кипения и осаждают титан аммиаком, как обычно, или при помощи свежеприготовленного 5 % - ного раствора купферона на холоду. [37]
Основным промышленным методом производства двуокиси титана является гидролиз растворов сернокислого титана и прокаливание полученного гидрата окиси титана. [38]
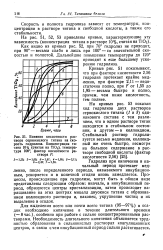 |
Влияние кислотности раствора сернокислого титана на скорость гидролиза. Концентрация титана 10 % ( считая на ТЮ2, температура 100, фактор кислотности раствора F. [39] |
На кривых рис. 53 показан ход гидролиза двух растворов сернокислого титана ( / и 3) одинакового состава с тем различием, что в одном растворе титан находится в стабильном состоянии, в другом - в коллоидном. [40]
Основным промышленным методом производства двуокиси титана является гидролиз растворов сернокислого титана и прокаливание полученного гидрата окиси титана. [41]
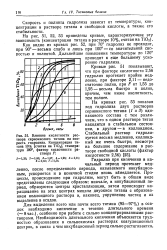 |
Влияние кислотности раствора сернокислого титана на скорость гидролиза. Концентрация титана 10 % ( считая на ТЮ2, температура 100, фактор кислотности раствора F. [42] |
На кривых рис. 53 показан ход гидролиза двух растворов сернокислого титана ( / и 3) одинакового состава с тем различием, что в одном растворе титан находится в стабильном состоянии, в другом - в коллоидном. [43]
В случае выделения основного вещества, например в растворе сернокислого титана, содержащего Fe, производят восстановление Fe в Fe железом и осаждают Н2ТЮ3 гидролизом в сильно кислом растворе, оставляя Fe в растворе, или же при получении квасцов из растворов сульфата алюминия сперва восстанавливают Fe в Fe действием сернистой кислоты или ее солей, а затем выделяют квасцы в твердую фазу, оставляя Fe в растворе. [44]
Страницы: 1 2 3