Раствор - трихлорид - железо
Cтраница 1
Растворы трихлорида железа и соли Мора должны быть подкислены серной кислотой. [1]
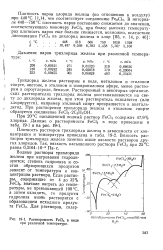 |
Растворимость FeCls в воде. [2] |
Вязкость растворов трихлорида железа заметно выше вязкости растворов других хлоридов. [3]
В две пробирки внесите по 1 - 3 капли растворов трихлорида железа и гексациано - ( 1П) феррата калия K3 [ Fe ( CN) 6l и по 5 - 10 капель воды. [4]
 |
Схема строения мишллы сульфида мышьяка ( III. [5] |
В стакан с холодной водой влить такое же количество раствора трихлорида железа. [6]
К полученному раствору постепенно прибавляют приблизительно 15 мл 16 % - пого раствора трихлорида железа до появления в водном слое желтой окраски. [7]
Возможность протекания реакции а подтверждается лишь тем, что тетрахлорферрат ( Ш) - ион появляется при разбавлении растворов трихлорида железа. Хорошим примером реакции типа в может служить реакция взаимодействия хлорида алюминия с трихлоридом железа. Механизм реакции г также убедительно доказан. Растворы трихлорида железа в триэтилфосфате совершенно аналогичны растворам FeCl3 в фосфорилхлориде. Таким образом, железо в растворе, вероятно, находится в форме тетрахлорферрат ( Ш) - иона, а образования хлор-ионов из POCls не происходит. [8]
В этот раствор одновременно при сильном перемешивании приливают охлажденные до 0 и отдельно приготов - ленные растворы 100 г тиосульфата натрия Na2S2O3 - 5H2O в 150 мл воды и 160 мл 18 % - иой соляной кислоты; смесь нчбя. К полученному раствору постепенно прибавляют приблизительно 15 мл 16 % - ного раствора трихлорида железа до появления в водном слое желтой окраски. [9]
В обе пробирки добавьте по 3 - 4 капли бензола или бензина и по 1 - 2 капли раствора трихлорида железа. Наблюдается ли изменение окраски органического растворителя. [10]
Для получения растворов хлорида железа используют стальную стружку и хлор. Часть готового раствора РеС13 восстанавливают с помощью стальной стружки до 32 % - ного раствора РеС12 и затем раствор дихлорида железа окисляют хлором до получения 35 - 45 % - ного раствора трихлорида железа. Растворы хлорида железа получают также улавливанием абгазного хлора отработанными травильными растворами или какими-либо другими растворами, содержащими FeClo. По патенту [64], промышленные отходы дихлорида железа концентрируют выпариванием с внешним подводом тепла и хлорируют, подавая испаренный хлор. [11]
В этот раствор, при сильном взбалтывании, одновременно вливают отдельно приготовленные и охлажденные до 0 растворы: 1) 250 г тиосульфата натрия Na2S2O8 - 5H2O в 400 мл воды и 2) 200 мл 36 % - ной соляной кислоты в 200 мл воды. При взбалтывании наблюдается обесцвечивание слабо окрашенного раствора, и в водном слое иногда остается небольшое количество выпавшей серы. Затем температуру раствора доводят до 0 и приливают к нему 120 мл 8 % - ного раствора трихлорида железа до появления светложелтого окрашивания. Реакционная смесь сначала окрашивается в темный цвет ( образуется комплексное соединение с тиосульфатом), но эта окраска быстро исчезает. [12]
В длннногорлои колбе емкостью 2 л готовят раствор 51 г дп хлорида серы SG12 в 200 & тстрахлорида углерода СС14 и охлаждают его до - 15 С. При взбалтывании наблюдается обесцвечивание слабо окрашенного раствора, и в водном слое иногда остается небольшое количество выпавшей серы. Затем температуру раствора доводят до 0 С и приливают к нему 120 мл 8 % - ного раствора трихлорида железа до появления светло-желтого окрашивания. Реакционная смесь сначала окрашивается в темный цвет ( образуется комплексное соединение с тиосульфатом), по эта окраска быстро исчезает. [13]
Возможность протекания реакции а подтверждается лишь тем, что тетрахлорферрат ( Ш) - ион появляется при разбавлении растворов трихлорида железа. Хорошим примером реакции типа в может служить реакция взаимодействия хлорида алюминия с трихлоридом железа. Механизм реакции г также убедительно доказан. Растворы трихлорида железа в триэтилфосфате совершенно аналогичны растворам FeCl3 в фосфорилхлориде. Таким образом, железо в растворе, вероятно, находится в форме тетрахлорферрат ( Ш) - иона, а образования хлор-ионов из POCls не происходит. [14]
Молибден в основном применяется при изготовлении нагревателей для высокотемпературной техники в условиях вакуума или в восстановительной атмосфере при температурах до 1700 С. В машиностроении он используется как облицовочный материал. Температура плавления молибдена 2625 С, но он окисляется уже при температурах выше 500 С, поскольку окис-ная пленка из МоО3 испаряется. Молибден устойчив в муравьиной, уксусной, щавелевой, фосфорной, соляной и фтористоводородной кислотах, в растворе трихлорида железа, хлорида аммония и многих других растворах солей. Устойчивость молибдена уменьшается в присутствии окислителей. [15]
Страницы: 1 2