Раствор - форма
Cтраница 1
Растворы эдадшоморфных форм вращают плоскость поляризованного света. Угли вр щени одинакрвы, однако одна: форма вращает плЬскость НОЛЯртг - 3ojaHH pfo света вправо. [1]
Авторы подчеркивают открытие новой для металлических растворов формы изотермы вязкости с точкою перегиба у таких сплавов, у которых... Они неправы только в том, что здесь у металлических систем имеется какое-то отличие от систем иных классов, где якобы, точка перегиба не указывает на образование соединений. [2]
Альтернативная модель формирования радиоколлоидов связывается с каким-либо из физико-химических процессов, которые могут обусловить рост содержания в растворе растворенной формы радионуклида свыше некоторой критической величины с0, отвечающей пределу растворимости. [3]
Пусть на электроде протекает катодный процесс, включающий предшествующую химическую реакцию, в результате которой из присутствующей в растворе формы Y образуется форма О. [4]
Определение состава и констант устойчивости смешанных ком плексов упрощается тогда, когда можно ограничиться учетом небольшого числа одновременно присутствующих в растворе форм комплексов. Подобным образом поступали, например, в работах [96], в которых с обратимым Hg-электродом установлены константы устойчивости смешанных комплексов Hg ( II), содержащих edta - анионы и ОН - - ионы, en и Неп, либо en и ОН - - ионы. [5]
Во всех случаях повышение давления приводит к образованию кристаллогидратов с большим содержанием кристаллизационной воды, что так же, как при атмосферном давлении, приводит к увеличению ТКР, так как гидратация в растворе форм более гидратиро-ванных в твердом состоянии меньше, а эндотермичность АЯраств больше. [6]
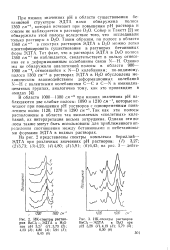 |
ИК-спектры растворов ВеСЬ - ЭДТА в Н2О при рН 3 27 ( /. 3 73 ( 2. 4 23 ( 3. 4 80 ( 4. 5 91 ( 5. 6 43 ( 6.| ИК-спектры растворов. [7] |
Сойер и Такетт [2] не обнаружили этой полосы вследствие того, что исследовали только растворы в D.O. Таким образом, по полосе в области 1360 см - 1 в спектрах растворов ЭДТА в D2O можно легко идентифицировать существование в растворах бетаиновых форм ЭДТА. [8]
На основании результатов работ, приведенных в табл. VI.1, нельзя отличить механизм (VI.1) - (VI.3) от механизма Геришера, включающего реакцию (VI.13) и обратимую химическую реакцию, в результате которой осуществляются взаимные превращения комплексов М ( г Xft и преобладающих в растворе форм комплексов. [9]
Показанная нами пропорциональность между анализируемым количеством гидрокарбонила в жидкой и в газовой фазе также косвенно подтверждает правильность методики определения гидрокарбонила кобальта. Можно предположить наличие в растворе других карбонильных форм, которые при отборе пробы, в результате снижения давления окиси углерода и водорода, а также охлаждения, переходят в гидро - или октакарбонил кобальта, искажая результаты анализа. [10]
При этом получали значения ( ге), соответствующее содержанию в растворе неколлоидных форм титана. [11]
Из изложенного следует, что при изучении равновесий электродных реакций, осложненных протонированием лигандов, целесообразно строить графики в координатах Е0, Ig [ X ], где X - депро-тонированный лиганд. Однако при записи уравнений суммарных электродных реакций, которые надо знать, например, при изучении их кинетики и механизма, необходимо использовать преобладающие в растворе формы лигандов, в том числе протонированные. Когда в растворе преобладает одна или несколько протонированных форм лиганда, а в состав комплексов входят лишь депротонированные лиганды, то, как следует из уравнений ( III. [12]
Многие комплексные системы быстро достигают равновесия при обычной температуре, и их можно изучать равновесными методами. Эти методы включают определение концентрационных переменных, коллигативных свойств и других физических свойств, таких, как спектры поглощения или электропроводность, которые зависят от факторов интенсивности различных присутствующих в растворе форм. [13]
Однако имеется исключение из этого правила. Так как ИК-спектры указывают, что водородная связь существует даже при сильном разбавлении, мы можем истолковать это наблюдение при помощи конкуренции межмолекулярных и внутримолекулярных водородных связей при отсутствии в растворе свободной формы. [14]
Если соединение, диэлектрическая проницаемость раствора которого измеряется, способно к самоассоциации в растворе или химическому взаимодействию с растворителем, или если в растворе присутствуют два компонента, вступающие в реакцию комплексообразования, то определяемая на опыте величина молекулярной поляризации складывается аддитивно из поляризаций всех присутствующих в растворе форм: растворителя, мо омера, димера, ассоциата и др. В связи с этим возникают задачи установления положения равновесия между существующими в растворе формами и нахождения значения ди-польного момента образующегося комплекса. [15]
Страницы: 1 2