Раствор - хлорид - аммоний
Cтраница 3
Кипячение способствует удалению из раствора хлорида аммония аммиака, образующегося при гидролизе этой соли. [31]
Окисление в 1 % растворе хлорида аммония ведет к образованию частиц с менее развитой поверхностью, чем при окислении в 1 % растворах хлоридов натрия и калия, в то же время: с увеличением концентрации хлорида аммония до 5 и 10 % происходит не уменьшение, как в случае хлоридов натрия и калия, а увеличение удельной площади поверхности и насыпной плотности, а, значит, и степени дисперсности, связанное с увеличением скорости окисления. Можно предположить, что механизм образования продуктов окисления в растворах хлорида аммония отличается от механизма окисления в растворах хлоридов натрия и калия. [32]
Оба электрода находятся в растворе хлорида аммония. [33]
В трех реактивных склянках находятся растворы хлорида аммония, сульфата аммония и аммиака. Как определить, какой раствор содержится в каждой склянке. [34]
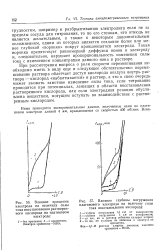 |
Влияние вращения электрода на величину силы тока восстановления растворенного кислорода на платиновом электроде.| Влияние глубины погружения. [35] |
Фон - 0 1 М раствор хлорида аммония; электрод сравнения - МИЭ. [36]
Какие продукты образуются при кипячении раствора хлорида аммония с порошком магния. [37]
Затем прибавляют - 10 мл раствора хлорида аммония и раствор мурексида и титруют раствором ЭДТА до изменения окраски раствора с желтой на фиолетовую. [38]
Смешивают равные объемы 1 М растворов хлорида аммония и аммиака. [39]
В пробирку наливают очень немного раствора концентрированного хлорида аммония. Добавляют равный объем щелочи. Осторожно нагревают до слабого кипения. Выделяющийся газ определяют по запаху. [40]
При кипячении карбоната кальция с раствором хлорида аммония образуется хлорид кальция, аммиак и двуокись углерода. [41]
При этом в 1 % растворе хлорида аммония образуется золотисто-желтый порошок, в 5 и 10 % растворах происходит переход от золотисто-желтого к охристо-желтому. Кроме того, чем кислее раствор, тем лучшим окислителем является кислород, в силу зависимости электродного потенциала от концентрации водородных ионов. Существует также мнение [4], что соли ( NH4C1, ( МН4) 2504, KCN), образующие с ионом окисляющегося металла комплексы, сильно смещают окислительно-восстановительный потенциал металла в отрицательную сторону, что приводит к увеличению скорости окисления. [42]
Чему равен рН 0 18 М раствора хлорида аммония. [43]
К полученному раствору прибавляют 1 мл раствора хлорида аммония и 2 мл реактива № 9 ( см. стр. [44]
К полученному раствору прибавляют 1 мл раствора хлорида аммония, 2 мл раствора фосфата натрия и по каплям 1 мл раствора аммиака; выпадает белый осадок. [45]
Страницы: 1 2 3 4