Сульфатный раствор
Cтраница 2
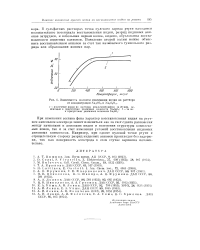 |
Зависимость полпотм извлечения ивдия из раствора от концентрации Na S03 u Na2S203. [16] |
В сульфатных растворах точка нулевого заряда ртути находится положительное потенциала восстановления индия, разряд индиевых анионов затруднен, и небольшая первая волна, видимо, обусловлена восстановлением индиевых катионов. [17]
В сульфатных растворах, которые используют в качестве электролита, медь присутствует в основном в виде двухвалентных ионов. Поэтому на границе раздела медь - раствор должна протекать электрохимическая реакция Си2 2е Си, стандартный потенциал которой равен 0 34 В. [18]
В сульфатном растворе ( например, 0 75М HaSCU) уран связывают в анионный комплекс, который, не поглощаясь, проходит через катионообменную колонку. Редкоземельные металлы при этом поглощаются количественно. Небольшую часть поглощенного урана вытесняют из колонки 0 75М Нз SOa. После этого редкоземельные металлы элюируют 6М НС1 [5 ] или цитратным буфером. Этим методом можно от редкоземельных элементов отделить торий, но при этом происходит некоторое перекрывание полос элюирования разделяемых металлов. Подобным образом может быть элюирован уран в виде отдельной фракции при помощи плавиковой [8 ] или щавелевой [15 ] кислот. Затем редкоземельные элементы выделяют из колонки соляной кислотой или определяют после сжигания ионита. [19]
В нейтральных сульфатных растворах цирконий быстро пассивируется; при плотностях тока, превышающих 10 - 3 а / см2, при неизменном потенциале образуется пассивная пленка. Цирконий принадлежит к металлам, образующим электрозапирающие слои. [20]
При электролизе сульфатных растворов на аноде образуется кислород, а в растворе накапливается серная кислота. Для поддержания рН прикатодного раствора в заданных пределах ( 2 5 - 4 0) катодные матрицы помещают в диафрагмированные ячейки, в которые подают очищенный раствор кобальтового электролита, либо нейтрализуют образующуюся серную кислоту гидроксидом кобальта. [21]
Однако из сульфатных растворов при 100 и DK 500 - 1000 а / м2 на катоде получаются хрупкие крупнокристаллические осадки, в то время как из хлорид-ных растворов - мелкокристаллические пластичные осадки. В качестве матриц лучше всего использовать луженые листы меди, окаймленные резиной. [22]
Скорость действия сульфатных растворов зависит от вида катиона в растворе. Различие в действии MgSO4 и Na2SO4 зависит также от состава цемента. Сульфат магния оказывает более сильное действие на низкоалюми-натные цементы, а сульфат натрия на высокоалюминатные. Это объясняется различным химизмом их действия. [23]
Этот выпаривания сульфатного раствора принят для Ку-чукского сульфатного завода, для которого расчетные расходные коэффициенты на 1 г сульфата натрия составляют: 0 93 т пара, 35 квт-ч электроэнергии, 0 015 т условного топлива. [24]
При электролизе сульфатных растворов в цветной металлургии применяют свинцовые аноды, а также аноды из сплавов свинца. Для повышения стойкости анодов из свинца и его сплавов с серебром или сурьмой предложено включать в состав электрода порошок металла платиновой группы или графита [6] таким образом, чтобы на поверхности электрода включения составляли от 0 1 до 5 % площади анода. При этом в процессе анодной поляризации на поверхности анода образуется более устойчивый слой двуокиси свинца. [25]
Торий из сульфатных растворов при рН 1 хорошо экстрагируется 0 1 М растворами алкилфосфатов в керосине. [26]
При гидролизе сульфатных растворов циркония осаждаются основные сульфаты. Состав их в зависимости от условий выделения колеблется в широких пределах и в определенных случаях отвечает кратным стехиометрическим отношениям. Обычно основными сульфатами циркония называют соединения, в которых содержится менее двух сульфатных групп на один атом циркония и более двух атомов циркония. Основные сульфаты имеют полимерную природу. [27]
Изучение состава промышленных сульфатных растворов показало, что платиновые металлы находятся в них в катионной форме. Применение катионитов для их извлечения не представляется возможным ввиду сильного конкурирующего влияния катионов неблагородных металлов. [28]
Радиационное окисление сульфатных растворов двухвалентного железа - один из наиболее полно изученных радиационно-хи-мических процессов. Поскольку механизм окисления хорошо известен, то данная система является основой широко применяемого дозиметра Фрике ( см. гл. [29]
При обработке сульфатных растворов соединений сурьмы амальгамами цинка 243, кадмия 224 241р 244 245 и олова получают амальгаму сурьмы в виде блестящей пасты. [30]
Страницы: 1 2 3 4