Стандартный раствор - щелочь
Cтраница 3
Чтобы убедиться в правильности титрования, к оттитрованному раствору прибавляют одну каплю стандартного раствора щелочи. Бледно-розовая окраска должна превратиться в бледно-желтую. [31]
Ацидиметрический метод, основанный на раствор ении вольфрамовой кислоты в определенном избытке стандартного раствора щелочи [11] или этиламина [7] и обратном титровании кислотой, также дает результаты, менее точные, чем весовой метод и, кроме того, включает те же операции отделения вольфрама от его спутников. [32]
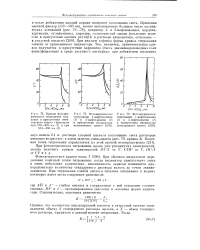 |
Фотометрическое титрование 1-нафтиламина ( 1 и 2-нафтиламипа ( 2 в присутствии индикатора метиленового синего. [33] |
Примем, что количество анализируемой кислоты в титруемой системе эквивалентно объему 5 стандартного раствора щелочи, а X - объем стандартного раствора, прилитого в данный момент титрования. [34]
Безбуферный метод отличается от буферного тем, что вместо буферных растворов готовится ряд стандартных растворов щелочи с разной концентрацией. Прибавленный к данным растворам индикатор полностью диссоциирует, поэтому окраска пропорциональна количеству индикатора. [35]
 |
Зависимость вязкости от температуры на примере пяти типов эпоксидных смол. [36] |
Разница между количеством добавленной кислоты и количеством прореагировавшей кислоты, определяемым путем титрования стандартным раствором щелочи, дает величину эпоксидного эквивалента. [37]
Эти методы давно разработаны и хорошо известны; примером их могут служить: титрование стандартным раствором щелочи многих карбоновых и сульфокислот, а также солей слабых органических оснований и сильных кислот, таких как гидрогалогениды алкалоидов, или же титрование стандартным раствором кислоты аминов и алкалоидов, а также солей щелочных и щелочноземельных металлов слабых органических кислот. [38]
Поэтому титруют две аликвотные порции анализируемого раствора: в первой - в водной среде находят объем стандартного раствора щелочи, эквивалентный суммарному содержанию кислот, во второй - водно-ацетоновой среде определяют содержание соляной кислоты. Последнее становится возможным вследствие уменьшения степени диссоциации уксусной кислоты в присутствии ацетона. [39]
Определение по остатку ( второй вариант) основано на реакции аммонийной соли с точно измеренным количеством стандартного раствора щелочи при кипячении, в результате чего удаляется аммиак, при этом расходуется эквивалентное соли количество щелочи. Остаток щелочи определяют титрованием стандартным раствором кислоты. [40]
Поэтому титруют две аликвотные порции анализируемого раствора: в первой - в водной среде находят объем стандартного раствора щелочи, эквивалентный суммарному содержанию кислот, во второй - водно-ацетоновой среде определяют содержание соляной кислоты. Последнее становится возможным вследствие уменьшения степени диссоциации уксусной кислоты в присутствии ацетона. [41]
В коническую колбу для титрования пипеткой перенос раствор H2SO4, добавляют 1 - 2 капли фенолфталеина и титрук стандартным раствором щелочи до появления бледно-розово окраски от последней капли стандартного раствора. [42]
Преимущество кулонометрического титрования при постоянной силе тока кислот электрогенерируемыми гидроксид-ионами заключается в том, что можно избежать необходимости предохранять стандартные растворы щелочей от атмосферного диоксида углерода. [43]
Поэтому титрование ведут в двух аликвотных порциях анализируемого раствора: в первой - в водной среде находят количество мл стандартного раствора щелочи, эквивалентное суммарному содержанию кислот, во второй - в водно-ацетоновой среде определяют содержание хлористоводородной кислоты. Последнее становится возможным вследствие уменьшения степени диссоциации уксусной кислоты в присутствии ацетона. [44]
Другой объемный метод заключается в окислении соединений рения до рениевой кислоты, например перекисью водорода, с последующим титрованием стандартным раствором щелочи. Рениевую кислоту можно не титровать, а осадить в виде перрената калия или таллия ( или даже нитрона) и определить весовым путем. Действительно, рениевая кислота была предложена [39] для определения калия, ввиду того что перренат является одной из наименее растворимых солей калия. [45]
Страницы: 1 2 3 4