Лиофильный коллоидный раствор
Cтраница 1
Лиофильные коллоидные растворы, в частности растворы ВМС, получаются, как было уже сказано, при самопроизвольном jac - пускании или растворении в подходящем растворителе; затраты внешней работы их получение не требует. [1]
Лиофильные коллоидные растворы, в частности растворы ВМС, получаются, как было уже сказано, при самопроизвольном распускании или растворении в подходящем растворителе; затраты внешней работы их получение не требует. [2]
В настоящее время лиофильные коллоидные растворы рассматриваются как истинные растворы высокомолекулярных веществ, обладающие некоторыми свойствами коллоидных растворов. [3]
Ответственными за устойчивость лиофильных коллоидных растворов являются полимолекулярные сольватные слои, окружающие коллоидные частицы; их разрушение в концентрированных растворах электролитов приводит лиофильные золи к коагуляции. [4]
Сделано заключение, что в лиофильных коллоидных растворах, образующихся при добавлении неионогенных ПАВ к гидрофобнымзолям, ноноэлектростатнческий фактор устойчивости играет несущественную роль. [5]
Растворы белков обладают многими свойствами, которые характерны для лиофильных коллоидных растворов. Молекулы белков не проходят через полупроницаемые мембраны, и это используется для их очистки от низкомолекулярных примесей при помощи диализа. Представляет большой интерес определение размеров, формы белковых молекул и молекулярных весов белков. Для этой цели используется целый ряд физико-химических методов. Так, белки в растворах седиментируют в ультрацентрифугах при ускорениях до 200 000 g; величины констант седиментации колеблются от 1 10 - 13 до 90 - 100 - 10 - 13 сек. Коэффициенты диффузии - в пределах от 0 1 10 - 7 до 10 - 10 - 7; средний удельный объем - около 0 75 см3 / г. Размеры и форму ( асимметрию) частиц белка определяют, кроме того, методами светорассеяния, двойного лучепреломления в потоке, измерениями вязкости, коэффициента вращательной диффузии, но, по-видимому, наиболее точно - прямым наблюдением в электронном микроскопе в тех случаях, когда молекулы белка достаточно велики и когда удается преодолеть технические затруднения. [6]
При добавлении неионогенных поверхностно-активных веществ ( ПАВ) к типично гидрофобным золям образуются лиофильные коллоидные растворы [1, 2], агрегативная устойчивость которых обеспечивается полимолекулярными сольватными оболочками, окружающими частицы дисперсной фазы. Коагуляция таких лиофильных золей наступает, по нашему мнению, в результате разрушения сольватных слоев. Это имеет место, например, в высококонцентрированных растворах солей. Необходимо, однако, отметить, что в принципе можно представить себе и другой механизм коагуляции ( и соответственно стабилизации), если допустить, что в присутствии электролитов происходит десорбция ПАВ с поверхности коллоидных частиц. [7]
 |
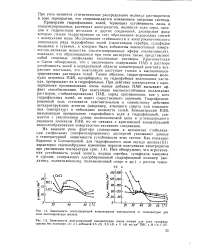
Схема зависимости концентрации мицелл ПАВ мылооб-разного, полуколлоидного типа от концентрации ПАВ в растворе. [8] |
Только такое термодинамическое рассмотрение системы в целом приведет, очевидно, к развитию статической теории лиофильных коллоидных растворов ПАВ. [9]
Далее, после образования твердой структуры частиц, величина их в случае сушки истинных растворов и гидрофобных суспензий остается неизменной. Частицы лиофильных коллоидных растворов незначительно уменьшаются и во втором периоде. В реальных условиях, учитывая значительное многообразие режимов и растворов при сушке, наблюдаются различные закономерности изменения размеров частиц. [10]
Fe ( OH) 3, A1 ( OH) 3 и др. Таким образом, растворам белков - типичным амфолитам - свойственна, как и лиофобным золям, способность менять не только величину, но и знак заряда частиц. Разница заключается в том, что в лиофильных коллоидных растворах белков изменение величины и знака заряда происходит от изменения концентрации водородных ионов, в связи с чем и самая физическая сущность перезарядки у белковых макромолекул иная, чем у мицелл лиофобных золей, где перезарядка обусловлена специфической адсорбцией ионов. [11]
Это явление известно под названием коллоидной защиты. Вещества, которые стабилизируют золи таким способом, - обычно высокомолекулярные соединения - желатина, альбумин, казеин, крахмал, декстрин, пектин, каучук и др. Сами они дают лиофильные коллоидные растворы, и потому называются защитными коллоидами. [12]
Примерами гидрофильных золей, теряющих устойчивость лишь в концентрированных растворах электролитов, являются золи серы, оксидов и гидроксидов металлов и других соединений, дисперсная фаза которых сильно гидратирована за счет образования водородных связей с молекулами воды. Исследования стабильности и электрокинетического потенциала ряда гидрофобных золей ( галогенидов серебра, сульфидов мышьяка и сурьмы), к которым были добавлены неионогенные поверхностно-активные вещества ( оксиэтиЛированные эфиры этиленгликоля), показали, что образовавшиеся при этом дисперсии также представляют собой типичные лиофильные коллоидные растворы. Краснокутская и Сапон обнаружили, что с увеличением содержания ПАВ в растворе устойчивость золей в определенной области концентраций реагента возрастает настолько, что коагуляция наступает только в высококонцентрированных растворах - солей. Таким образом, гидратированные молекулы неионных ПАВ, адсорбируясь на гидрофобных коллоидных частицах, превращают их в гидрофильные. При действии электролитов с однозарядными противоионами очень малые добавки ПАВ вызывают эффект сенсибилизации. При коагуляции высокоустойчивых коллоидных растворов, стабилизированных ПАВ, заряд противоионов, как у всех гидрофильных золей, не имеет существенного значения. Гидрофилизи-рованный золь становится чувствительным к совместному действию дегидратирующих агентов ( например, этилового спирта или повышенных температур) и небольших количеств солей. Концентрация ПАВ, вызывающая превращение гидрофобного золя в гидрофильный, снижается с увеличением длины оксиэтиленовой цепи и углеводородного радикала молекулы ПАВ, но не связана с критической концентрацией мицеллообразования поверхностно-активного соединения. [14]
Страницы: 1