Титруемый раствор - соль
Cтраница 1
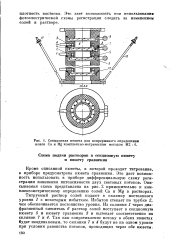 |
Секционная кювета для непрерывного определение ионов Са и Mg комплексно-метрическим методом М2. 4. [1] |
Титруемый раствор солей подают в склянку постоянного уровня 1 с некоторым избытком. Избыток стекает по трубке 2, чем обеспечивается постоянство уровня. [2]
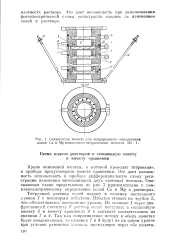 |
Секционная кювета для непрерывного определения ионов Са и Mg комплексно-метрическим методом М2. 1. [3] |
Титруемый раствор солей подают в склянку постоянного уровня 1 с некоторым избытком. Избыток стекает по трубке 2, чем обеспечивается постоянство уровни. [4]
В начале титрования по мере приливания растворов, содержащих осаждающие ионы, к титруемым растворам солей величины pKt и рАп изменяются медленно. Незначительное изменение pKt и рАп в начале титрования объясняется тем, что в растворе остается еще достаточно большой избыток осаждаемых ионов. [5]
В начале титрования по мере приливания растворов, содержащих осаждающие ионы, к титруемым растворам солей величины pKt и рАп изменяются медленно. Незначительное изменение pKt и рАп в начале титрования объсняется тем, что в растворе остается еще достаточно большой избыток осаждаемых ионов. [6]
В начале титрования по мере приливания растворов, содержащих осаждающие ионы, к титруемым растворам солей величины pKt и рАп изменяются медленно. Незначительное изменение pKt и рАп в начале титрования объясняется тем, что в растворе остается еще достаточно большой избыток осаждаемых ионов. [7]
Титруют нитратом тория с ртутным капающим электродом при - 1 7 В ( Нас. Можно сначала добавить к титруемому раствору соли железа ( III) и затем титровать с палл адиевым электродом раствором соли тория ( IV), который вытесняет железо ( III) из era комплекса с фторидом. [8]
Краузе нашел, что хорошо промытая суспензия В1РС дает отчетливую реакцию на ионы NOjj с дифениламином и серной кислотой. Реакция на NOJ тем более интенсивна, чем большей концентрацией обладает титруемый раствор соли висмута. Но при титровании раствора висмута указанной выше концентрации основной нитрат висмута соосаждается в настолько малых количествах, что это практически не отражается на точности результатов. [9]
Среди объемных методов определения сернистого натрия имеется интересный метод определения его титрованием железосинеродистой солью. Большим преимуществом этого метода является непосредственное определение сернистого натрия при одновременном присутствии в титруемом растворе сернистокислых и серноватистокислых солей. [10]
При титровании необходимо брать не более 1 - 2 капель индикатора, так как индикаторы сами являются кислотами или основаниями и на их нейтрализацию расходуется некоторое количество раствора титранта. Кроме того, на изменение окраски индикатора оказывают влияние концентрация самого индикатора, присутствие в титруемом растворе солей, коллоидов, растворенного ССЬ, температура раствора, природа раствора, природа растворителя. [11]
Образующаяся марганцеватистая кислота выделяется в виде объемистого почти черного осадка. Реакция протекает не вполне стехиометрически вследствие перехода в осадок некоторого количества двухвалентного марганца с образованием нерастворимых манганатов: МпМпО3, Мп ( НМпО3) 2, а также из-за адсорбции его ионов на гидратизированной двуокиси марганца. Указанный процесс связывания двухвалентного марганца можно в значительной степени предупредить, вводя в титруемый раствор соли цинка, кальция, магния, бария и некоторые другие. Обычно титрование марганца производят после нейтрализации солянокислых растворов окисью цинка. [12]
Страницы: 1