Двухкомпонентный раствор
Cтраница 3
Обычно коэффициент распределения / компонентов между двумя двухкомпонентными растворами определяют как отношение мольных долей компонентов в одном растворе, деленное на отношение мольных долей компонентов в другом равновесном растворе. [31]
В результате этого вытеснения на поверхности адсорбента образуется гомогенный поверхностный двухкомпонентный раствор. [32]
Измерение показателя преломления дает возможность непосредственно установить концентрацию двухкомпонентных растворов. Для этого используются эмпирические расчетные формулы и графики, так как теоретический расчет показателей преломления растворов с требуемой степенью точности в настоящее время еще невозможен. [33]
Измерение показателя преломления дает возможность непосредственно установить концентрацию двухкомпонентных растворов. Для этого используются эмпирические расчетные формулы и графики, так как теоретический расчет показателей преломления растворов с требуемой степенью точности в настоящее время еще невозможен. Сочетание рефрактометрических измерений с определением других физических свойств или с химической обработкой исследуемого вещества позволяет анализировать тройные и более сложные смеси и определять таким образом состав многих важных промышленных продуктов и биологических объектов. [34]
 |
Типичная пограничная кривая двухкомпонентной смеси. [35] |
Уравнение ( 10) описывает как кривую сосуществования двухкомпонентного раствора, так и пограничную кривую. Уравнение пограничной кривой определяет связь между давлением и температурой на линии, ограничивающей область двухфазных состояний при заданной средней концентрации. [36]
Изопиестические парциальные величины не имеют смысла в случае двухкомпонентного раствора соль - вода, поскольку изменение состава раствора здесь несовместимо с постоянством лш. [37]
Здесь и в последующем изложении в целях простоты рассматриваются только двухкомпонентные растворы. Обобщение на случай большего числа компонентов принципиальных трудностей не представляет. [38]
Для учета взаимодействия мигрантов при катионном обмене предлагается модель двухкомпонентного раствора [1, 17], основанная на предположении о независимости процесса ионного обмена для каждой пары ионов от содержания других ионов. [39]
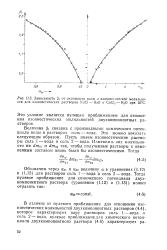 |
Зависимость ( 5i от активности воды и изопиестической моляльно-сти для изопиестических растворов КаС1 - Н2О и СаС12 - HjO при 25ЭС. [40] |
Это условие является нулевым приближением для отношения изопиестических моляльностеи двухкомпонентных растворов. [41]
Допустим, что приемлемо нулевое приближение для химических потенциалов двухкомпонентного раствора - условие (4.6) гл. [42]
Скривеном [65] получено также автомодельное решение, когда жидкость - двухкомпонентный раствор и рост пузырька зависит не только от теплопроводности, но и от диффузии испаряющейся компоненты в жидкости. В работе [57] проведено обобщение результатов [65 ] на случай роста пузырька в неоднородном температурном поле. Выведено соотношение, справедливое для двух режимов: 1) когда рост пузырька определяется силами инерции; 2) теплоотдачей. [43]
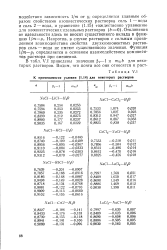 |
К применимости условия для некоторых растворов. [44] |
Напротив, в случае растворов с сильным проявлением взаимодействия свойства двухкомпонентных растворов соль - вода не имеют существенного значения. Функция 1 / т - z / i определяется в основном взаимодействием компонентов раствора при смешении. [45]
Страницы: 1 2 3 4