Проводящий раствор
Cтраница 2
Способы определения константы ссс ячейки для диэлкометрии хорошо проводящих растворов рассмотрены выше ( стр. [16]
Инверсионный механизм обменных реакций, протекающих в проводящих растворах по ионному механизму, был открыт Вальденом. С, соединенным с четырьмя различными группами, и часто проявляющиеся в изменении знака оптической активности ( правое и левое вращение плоскости поляризации), получили название вальденоеского обращения. [17]
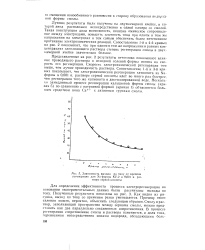 |
Зависимость выхода по току от времени регенерации для Na-формы КУ-2 в 0 001 н. растворе серной кислоты. [18] |
Представленные на рис. 2 результаты отчетливо показывают влияние проводящего раствора и исходной солевой формы ионита на скорость его регенерации. [19]
В этом случае оптимальная чувствительность достигается при измерениях плохо проводящих растворов. [20]
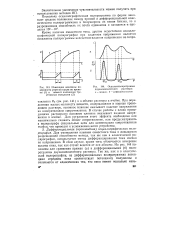 |
Изменение величины поверхности ртутной капли во времени ( / и момент наложения треугольных импульсов ( 2. [21] |
При определении малых количеств веществ, содержащихся в хорошо проводящем растворе, основное влияние оказывает падение напряжения на измерительном сопротивлении. В Случае работы с плохо проводящими растворами основное влияние оказывает падение напряжения в ячейке. Для устранения этого эффекта необходимо или максимально снижать общее сопротивление, или предусматривать в по. [22]
Электролит может содержать самые разнообразные соединения, которые образуют проводящий раствор. Электропроводность раствора должна быть, конечно, достаточно высокой, чтобы исключить потери электрической энергии обусловленные выделением тепла. [23]
Многие ионные соединения растворяются в безводном гидразине с образованием проводящих растворов. Вследствие высокой диэлектрической проницаемости этого растворителя в нем практически полностью диссоциированы галогениды щелочных металлов и тет-раалкиламмония, а также многие карбоновые кислоты. [24]
Иодиды щелочных металлов растворяются в расплавленном иоде с образованием проводящих растворов, типичных для слабых 1: 1-электролитов. [25]
Многочисленные исследования показывают, что омическое сопротивление даже в плохо проводящих растворах заметно не влияет на работу коррозионных микроэлементов. [26]
Поскольку чистый фтористый водород не проводит электрический ток, для получения проводящих растворов добавляют фтористые соли щелочных металлов. Они хорошо растворяются в жидком фтористом водороде. Кислый фторид аммония не применим, так как при электролизе могут выделиться фториды азота. Кислый фторид лития полностью диссоциирует на фтористый литий и фтористый водород уже при комнатной температуре. Применение кислых фторидов рубидия в качестве электролита затруднено вследствие их большой гигроскопичности и дороговизны. [27]
Оказывается, в качестве такого электрода можно использовать стеклянный капилляр заполненный проводящим раствором. [28]
Электролиты - это вещества, которые, растворяясь в воде, дают проводящие растворы. При этом образуются ионы - частицы, несущие электрические заряды. Перемещаясь, заряды переносят ток по мере того, как высвобождается энергия, запасенная в химической системе, которая заключена в батарейку. Работа обычных батареек, в которых используется химическая энергия цинка и оксида ртути, обеспечивается водными электролитами. Таким образом, стоящая перед химиками проблема была четко определена - необходимо создать батарейку, работающую в отсутствие воды. [29]
Он предположил, что при растворении в воде вещество, способное давать проводящий раствор, всегда самопроизвольно диссоциирует на ионы, причем степень диссоциации весьма значительна для солей, сильных кислот и оснований, особенно в разбавленных растворах. [30]
Страницы: 1 2 3 4