Твердый раствор - водород
Cтраница 3
Как видно из рис. 7, изотерма системы иридий - водород для 25 представляет собою плавную кривую и отвечает образованию твердого раствора водорода в иридии, без тех усложнений, с которыми мы встречаемся у палладия и родия. [31]
Химические свойства гидридов изучены намного лучше, чем физические, поскольку гидриды долгое время не признавались как индивидуальные химические соединения, а считались твердыми растворами водорода в металлах. Таблица по химическим свойствам гидридов наиболее полная и лучше всего характеризует гидриды как соединения. [32]
В состав катодного осадка водород может включаться в различной форме: возможно механическое включение пузырьков, прилипающих к поверхности и затем заращиваемых металлом; возможно образование твердых растворов водорода в металле или гидридов металлов. С повышением температуры электролиза содержание водорода в осадке понижается, несмотря на то что перенапряжение уменьшается и выделение водорода может усилиться. [33]
Изучением растворимости водорода в золотопалладиевых сплавах с содержанием золота 11 и 25 % установлено, что в присутствии золота при насыщении палладия водородом образуется только более бедный водородом - твердый раствор водорода в палладии. [34]
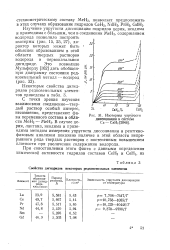 |
Свойства дигидридов некоторых редкоземельных элементов.| Изотермы упругости. [35] |
Изучение упругости диссоциации гидридов церия, неодима и празеодима с большим, чем в соединении МеН2, содержанием водорода позволило построить изотермы ( рис. 15, 25, 27), характер которых может быть объяснен образованием в этой области твердых растворов водорода в первоначальном дигидриде. [36]
В металлах этого типа вероятна ионизация водорода e и внедрение протонов в кристаллическую решетку. Образуемые гидриды представляют собой твердые растворы водорода в металле. Как показано для никеля [82], водород внедряется в октаэдрические пустоты кристаллической решетки. На границе фаз гидрид никеля - никель возникают значительные напряжения, обуславливающие появление трещин при распаде гидридной фазы. [37]
Таким образом, можно сделать вывод, что при действии халькогеноводородов ( HaS, H2Se, Н2Те) при температурах до 1000 С и выше на металлы, активные по отношению к водороду, нельзя получить селенидов. По-видимому, в твердом растворе водорода в металле связь Me - Н достаточно прочна для того, чтобы водород мог быть заменен атомом халькогена. К таким активным металлам относятся Ti, Sc, Y и лантаноиды, остальные металлы будут взаимодействовать с H2Se в присутствии водорода и давать селениды, однако температурные условия, продолжительность нагревания и дисперсность исходных порошков металлов будут играть существенную роль. [38]
Гидриды металлов и сплавов представляют собой твердые растворы водорода в металлах и, хотя реакции металлов с водородом изучаются уже более 100 лет, предсказать для интерметаллчческих соединений содержание водорода в нчх невозможно. Поэтому известные в настоящее время гидриды найдены экспериментально и в большинстве случайно. Отсутствие сформировавшихся представлений о природе абсорбции водорода металлами затрудняет разработку водородных аккумуляторов с заданными свойствами на основе гидридов. [39]
Элементы III, IV и V побочных подгрупп образуют переходные гидриды ме-таллоподобного характера. Считается, что переходные гидриды - твердые растворы водорода в металлах: например, один объем палладия поглощает до 700 объемов водорода. [40]
Дальнейшее присоединение водорода к гидриду LnHa приводит к образованию гидридов промежуточного состава ЬпНг - з - В случае La, Се, Рг и Nd гидриды состава до LnH2 7 - 2 8 представляют собой однофазные системы со структурой LnH2, однако по мере сорбции водорода структура претерпевает сжатие. Таким образом, эти гидриды являются твердыми растворами водорода в дигндриде. Твердые растворы водорода в GdH2 устойчивы только до состава GdH2t4, далее структурный анализ отмечает новую фазу, принадлежащую GdH8, которая полностью замещает фазу дигидрида при последующем гидрировании. [41]
Металлы, получаемые восстановлением их оксидов водородом, в той или иной степени насыщаются водородом. Во многих случаях образуются фазы внедрения - твердые растворы водорода в металле. Так ведут себя железо, кобальт, никель, хром, молибден, алюминий, серебро, платина и другие металлы. Водород находится в металле в виде положительно заряженных ионов. [42]
Эти расхождения объясняются способностью никеля растворять в себе огромные количества водорода. Поэтому нередко вместо электродного потенциала никеля измеряют потенциал твердого раствора водорода в никеле. Истинное значение электродного потенциала никеля можно получить лишь из измерений электродного потенциала амальгамы никеля, оно равно - 0 250 В. [43]
Реакции с металлами - побочных подгрупп I-VIII групп периодической системы приводят к образованию металлоподобных гидридов - твердых веществ с металлическими свойствами, соединений или нестехиометричееких твердых растворов. Металлоподобные, или металлообразные гидриды - это в основном твердые растворы водорода в металлах. По свойствам и характеру химической связи эти гидриды сходны с металлами. [44]
Водородная хрупкость стали может появиться при нагреве ее в среде водорода при высоких температурах ( выше 300 С) и высоких давлениях. При данных условиях происходит растворение водорода в металле и образуется непрочный хрупкий твердый раствор водорода в железе. Одновременно с этим из атомарного водорода, присутствующего в стали, могут образовываться моле кулы водорода, выделяющиеся по границам зерен ме талла. [45]
Страницы: 1 2 3 4