Разбавленный концентрированный раствор
Cтраница 3
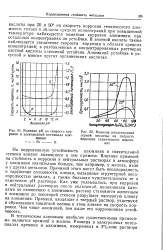
Функции кислотности и основности измерены для многих веществ в разбавленных и концентрированных растворах - в воде и органических растворителях и приведены в специальных монографиях и справочниках. Для серной кислоты разной концентрации изменение функции кислотности Я0 графически изображено на рис. 28: Н0 быстро растет при повышении концентрации, причем для 97 % - ной H2SO4 Я0 - 9 и / 10109 моль / л, далеко превосходя по величине возможную концентрацию ионов гидроксония. Это связано с тем, что кислотность концентрированной серной кислоты в основном определяется ее недиссоциированной и протонированной формами. На рис. 29 представлена зависимость функции Я от концентрации водного раствора NaOH; из этих данных следует, что щелочность реальных растворов растет быстрее, чем их концентрация. [31]
Перечисленные обстоятельства обусловливают различный методологический подход к теоретическому описанию свойств разбавленных и концентрированных растворов. Поэтому здесь теоретические вопросы электропроводности неводных растворов будут рассмотрены раздельно для концентрированных растворов, в частности для двойных жидких систем, представляющих особый интерес для практики электроосаждения металлов, и для разбавленных растворов электролитов. [32]
 |
Эффект Тананаева. [33] |
С этой целью осаждение каждого осадка он проводил параллельно из разбавленных и концентрированных растворов. [34]
К 1 - 3 кусочкам цинка прилить в отдельных пробирках разбавленных и концентрированных растворов кислот: соля-ной, серной и азотной. [35]
К 1 - 3 кусочкам цинка прилить в отдельных пробирках разбавленных и концентрированных растворов кислот соляной, серной и азотной. [36]
В табл. ( 82 - 1) сравниваются результаты теорий разбавленных и концентрированных растворов бинарных электролитов. Чтобы выявить сходство, в выражениях для характеристик переноса из разд. Все три характеристики переноса 0 о и - в те Рии концентрированных растворов можно рассчитать в зависимости от концентрации, исходя из независимых измерений трех величин Д к и tQ ( разд. [37]
 |
Сравнение результатов для бинарных электролитов. [38] |
В табл. ( 82 - 1) сравниваются результаты теорий разбавленных и концентрированных растворов бинарных электролитов. Чтобы выявить сходство, в выражениях для характеристик переноса из разд. [39]
Испытано очень большое число различных неорганических и органических стабилизаторов с разбавленными и концентрированными растворами перекиси водорода. Наибольший успех достигнут ( особенно для высококонцентрированной перекиси) при применении станната натрия или 8-оксихинолина ( оксина), в том и другом случаях в присутствии растворимого пирофосфата или смеси фосфата и пирофосфата. Рассмотрим отдельно каждое из этих трех веществ ( станнат, оксин и фосфаты), а затем другие стабилизаторы. [40]
Разница заключается в том, что в первом случае получается, кроме разбавленного, концентрированный раствор, а во втором случае ( теоретически) вода просто переносится из большого резервуара с исходным раствором в большой резервуар с чистой водой. [41]
Любопытно, что подобный подход предсказывает сходный вид концентрационной зависимости выхода превращения в разбавленных и концентрированных растворах, что и наблюдается экспериментально. [42]
 |
Влияние рН на скорость коррозии и электродный потенциал алюминия - - - - - - - П. - - - - - - - - К.| Влияние концентрации серной кислоты на скорость коррозии технического алюминия. [43] |
В азотной кислоте также наблюдается увеличение скорости коррозии в области средних концентраций; в разбавленных и концентрированных растворах азотной кислоты алюминий устойчив. Алюминий устойчив в уксусной и многих других органических кислотах. [44]
Бек, Кодл, Ковингтон и Винн-Джонс [70] обратили внимание на различие поведения стеклянных электродов в разбавленных и концентрированных растворах кислот. Время от времени наблюдается смещение потенциала в обратном направлении и достигнуть устойчивого значения потенциала не удается даже через большой промежуток времени. Имеется критическая концентрация, выше которой систематически проявляется иной тип поведения электродов. [45]
Страницы: 1 2 3 4