Крепкий раствор - соль
Cтраница 1
Крепкие растворы солей оказывают разнообразное действие на высокомолекулярные вещества. Они увеличивают взаимодействие молекул и отдельных составляющих их групп, снижают гидратацию и С-потенциал. Общепринятого и законченного представления о механизме высаливания пока еще не имеется. [1]
При обработках и хранении метилальбумин необходимо оберегать от воздействия кислот и крепких растворов солей. Полученный препарат должен хорошо растворяться в воде. Используют его в виде 1 % - ного водного раствора. Водный раствор метилальбумина при 5 сохраняется в течение одного месяца. [2]
Все осадки, содержащие амиды и гидроксилы, до некоторой степени растворяются в крепких растворах солей аммония. Бриттон и Вильсон [6] наблюдали, что в то время как растворы окиси ртути ( II) в растворах сульфата и нитрата аммония не содержат титрующегося аммиака, растворы окиси ртути в бромиде аммония оказываются явно аммиачными. Бриттон и Вильсон чисто теоретически полагают, что это происходит потому, что рассматриваемый раствор содержит диамминовый комплекс ртути ( II), который является настолько устойчивым, что только ион брома ( сам чрезвычайно прочно связанный) способен освободить аммиак. [3]
Все осадки, содержащие амиды и гидроксилы, до некоторой степени растворяются в крепких растворах солей аммония. Бриттон и Вильсон [6] наблюдали, что в то время как растворы окиси ртути ( II) в растворах сульфата и нитрата аммония не содержат титрующегося аммиака, растворы окиси ртути в бромиде аммония оказываются явно аммиачными. Бриттон и Вильсон чисто теоретически полагают, что это происходит потому, что рассматриваемый раствор содержитдиамминовый комплекс ртути ( II), который является настолько устойчивым, что только ион брома ( сам чрезвычайно прочно связанный) способен освободить аммиак. [4]
Наилучшие выходы по току, с расчетом на основной продукт - этан - получаются при электролизе очень крепких растворов нейтральных и слабокислых солей с диафрагмой на гладких платиновых анодах без нагревания. [5]
Сначала пробовали применять розиндулин и другие красители с достаточно положительным нормальным потенциалом, но они были почти нерастворимы в крепких растворах соли и, следовательно, не были пригодны как катализаторы. [6]
Надо полагать, что и в водном растворе поваренная соль разлагается всегда с выделением натрия, а не просто вступает в двойное разложение с водою ( NaCl - ( - Н2О NaHO -) - НС1), как видно из того, что при быстром разложении током насыщенного раствора поваренной соли на аноде является много хлора, а на ртутном катоде образуется амальгама натрия, лишь медленно действующая на крепкий раствор соли. На основании этого вида разложения соли ныне производят заводскую переработку поваренной соли в хлор и едкий натр. [7]
В отличие от алюминия, цинк растворяют не только сильные щелочи, но и аммиак. Растворимость цинка в крепких растворах солей аммония связана с их частичным гидролизом, благодаря которому в жидкости всегда имеются небольшие количества МНз и свободной кислоты, снимающие защитную пленку. [8]
В отличие от алюминия, цинк растворяют не только сильные щелочи, но и аммиак. Растворимость цинка в крепких растворах солей аммония связана с их частичным гидролизом, благодаря которому в жидкости всегда имеются небольшие количества МНз и свободной кислоты, снимающие защитную пленку. [9]
 |
Вечный фонтан соленой воды в океане.| Соляные пальцы ( увеличено. [10] |
Нечто подобное соленому фонтану вы можете наблюдать у себя дома. Наполните аквариум до половины холодной пресной водой, а сверху осторожно налейте теплый крепкий раствор соли, слегка подкрашенный чернилами. Чернила нужны только для большей наглядности. [11]
По отношению своих соединений к аммиаку ртуть значительно отличается от цинка и кадмия. Комплексные продукты присоединения NH3 не характерны для иона Hg2 и образуются только в присутствии избытка крепкого раствора солей аммония. Интересно, что две молекулы NH3 удерживаются ионом Kg2 несравненно прочнее двух других и в растворах комплексных аммиакатов. [12]
По отношению своих соединений к аммиаку ртуть значительно отличается от цинка и кадмия. Комплексные продукты присоединения ЫНз не характерны для иона Hg - ц образуются только в присутствии избытка крепкого раствора солей аммония. При этих условиях были получены, в частности, [ Hg ( NH3) i ] SO. Наиболее известным из соединений подобного типа является [ Н § ( МНз) г С12 ( плавкий белый преципитат), образующийся в виде белого кристаллического осадка при действии МНОН на раствор HgCI2, содержащий избыток крепкого раствора МН. Интересно, что две молекулы МНз удерживаются ионом Hg2 несравненно прочнее двух других и в растворах комплексных аммиакатов. [13]
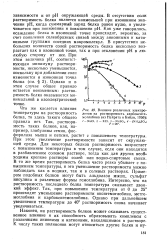 |
Влияние различных электролитов на растворимость карбоксиге-моглобина ( из Н. ейрата и Бэйли, 1956. [14] |
При этом увеличение растворимости зависит от окружающей среды. Для некоторых белков растворимость возрастает с повышением температуры в том случае, если они находятся в разбавленном солевом растворе, тогда как для других необ ходимы крепкие растворы солей или водно-спиртовые смеси. В то же время растворимость белка часто резко убывает с повышением температуры, и это уменьшение растворимости можно наблюдать как в водных, так и в солевых растворах. Примером подобных белков могут быть альдолаза мышц, сульфат инсулина и различные формы гемоглобина. Интересно, что на растворимость последнего белка температура оказывает двоякий эффект. Так, при повышении температуры от 0 до 25 происходит уменьшение растворимости оксигемоглобина, метге-моглобина и карбоксигемоглобина. Однако при дальнейшем увеличении температуры до 40 растворимость снова начинает увеличиваться. [15]
Страницы: 1 2