Знание - энергия
Cтраница 1
Знание энергии и внешних параметров системы позволяет найти выражение для работы и обобщенные силы. [1]
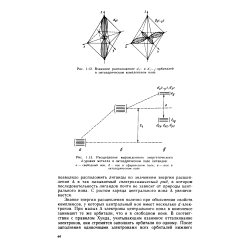 |
Взаимное расположение d2 - - и й, - орбиталей в октаэдрическом комплексном ионе. [2] |
Знание энергии расщепления полезно при объяснении свойств комплексов, у которых центральный ион имеет несколько d - элек-тронов. При малых Д электроны центрального иона в комплексе занимают те же орбитали, что и в свободном ионе. В соответствии с правилом Хунда, учитывающим взаимное отталкивание электронов, они стремятся заполнить орбитали по одному. [3]
Знание энергии связи позволяет более точно рассчитать теоретическую прочность. [4]
Знание энергии связей необходимо для суждения об их прочности, а следовательно, и о возможности той или иной реакции. Однако следует заметить, что прочность связей ( термодинамический фактор) определяет направление реакций только в состоянии равновесия. При удалении от состояния равновесия прочность связей уже не является решающим фактором в определении направления реакции. Оно зависит от кинетического фактора - энергии активации. [5]
Знание энергии активации очень важно для понимания движущих сил химических реакций. [6]
 |
Взаимное расположение d. - и о - орбиталей в октаэдрическом комплексном ионе. [7] |
Знание энергии расщепления полезно при объяснении свойств комплексов, у которых центральный ион имеет несколько d - элек-тронов. При малых Д электроны центрального иона в комплексе занимают те же орбитали, что и в свободном ионе. В соответствии с правилом Хунда, учитывающим взаимное отталкивание электронов, они стремятся заполнить орбитали по одному. [8]
Знание энергий диссоциации представляет интерес как с теоретической, так и с практической точки зрения. Энергия диссоциации является наиболее непосредственной мерой силы связи. Знание энергии диссоциации связей значительно способствует пониманию взаимного влияния атомов в молекуле. С практической точки зрения энергии связей полезны для выяснения механизмов химических реакций, например возможности возникновения неустойчивых промежуточных про - дуктов: радикалов, атомов и ионов. [9]
Знание энергий диссоциации представляет интерес как с теоретической, так и с практической точки зрения. Энергия диссоциации является наиболее непосредственной мерой силы связи. Знание энергии диссоциации связей значительно способствует пониманию взаимного влияния атомов в молекуле. С практической точки зрения энергии связей полезны для выяснения механизмов химических реакций, например возможности возникновения неустойчивых промежуточных продуктов: радикалов, атомов и ионов. [10]
Знание энергий связи ядер позволяет рассчитать энергетический баланс не только для довольно редкого процесса полного расщепления, но и для любых процессов распадов и взаимных превращений ядер. [11]
Знание энергии диссоциации ОН-связи в гидроперекиси циклогексила позволяет найти теплоту образования свободного циклогексилпероксидного радикала. Точность приведенных величин лежит, по-видимому, в пределах 3 ккал / моль. [12]
Знание энергий связи ядер позволяет рассчитать энергетический баланс не только для довольно редкого процесса полного расщепления, но и для любых процессов распадов и взаимных превращений ядер. [13]
Несмотря на недостаток знаний энергии возбуждения таких сложных молекул, как окрашенные органические соединения, и на невозможность строгого квантово-механического расчета молекул красителей, были достигнуты известные успехи в расчете спектров некоторых сопряженных систем, характерных для молекул красителей путем совместного применения индуктивных методов органической химии и квантово-механических принципов. Волновое уравнение механики подсказало выбор правил, которые разрешают или запрещают электронные переходы на разные уровни. [14]
 |
Зависимость логарифма константы скорости реакции от обратной температуры ( по Арреинусу.| Зависимость константы скорости реакции от температуры в широкой области температур ( по Аррениусу. [15] |
Страницы: 1 2 3