Хлоратный раствор
Cтраница 1
Хлоратный раствор подают в верхнюю часть первого реактора, а соляную кислоту в нижнюю часть. [1]
При поляризации в хлоратных растворах рост кривой не замедляется. [3]
Образующийся в конечном итоге хлоратный раствор нагревают до 100 С, донасыщают хлоратом, а затем кристаллизуют политермическим способом. [4]
При поляризации ОРТА в чистых хлоратных растворах или в хлорид-хлоратных растворах с малым содержанием хлорида могут создаться критические условия, при которых ОРТА перестают быть коррозионно-устойчивыми. [5]
Углеродистая сталь при контакте с горячими хлоратными растворами подвергается весьма интенсивной коррозии на границе раздела фаз раствор - пар. [6]
Отбельщику необходимо тщательно следить за герметичностью всех соединений трубопроводов химикатов, арматуры и аппаратов. В помещениях, где работают с хлоратными растворами, запрещается курить, проводить какие-либо работы, связанные с применением огня; не допускается соприкосновение спецодежды, запачканной хлоратом натрия, с нагретыми поверхностями; рекомендуется регулярная обмывка водой полов и стен. При пуске хлоратных насосов сальники должны быть политы водой во избежание взрыва подсохшего хлората. Спецодежду необходимо каждый день стирать и надевать чистую. Пользоваться кожаными перчатками и обувью не рекомендуется, так как хлорат очень трудно отмывается от кожи. [7]
При поляризации с постоянной плотностью тока потенциал титана возрастает во времени. С увеличением плотности тока скорость формирования пленки на титане возрастает; при поляризации в хлоратных растворах образование окисной пленки также значительно ускоряется. [9]
Изучено [ ЮОа ] поведение титана, платины и стальных катодов в хлорид-хлоратных растворах. Плотность тока катодной защиты стальных поверхностей должна быть выше предельного диффузионного тока процесса восстановления гипохлорита. Титан и платина в хлориД - хлоратных растворах в присутствии активного хлора пассивны и без наложения тока поляризации. [10]
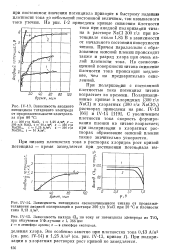
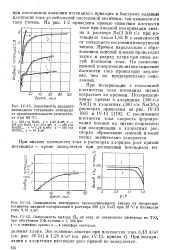
На рис. V-6, по данным рис. V-4 и V-5, приведена зависимость отношения парциальной скорости растворения платины к скоростям других процессов, протекающих одновременно на аноде, от потенциала. Отношение скорости растворения платины к скорости выделения кислорода незначительно меняется с ростом потенциала и практически не зависит от природы аниона и преобладающего анодного процесса. В интервале потенциалов 1 9 - 2 8 В это отношение составляет от 0 7 - 10 - 5 до 2 5 - 10 - 5 для хлоридных и хлоратных растворов. [11]
Страницы: 1