Водный раствор - серная кислота
Cтраница 3
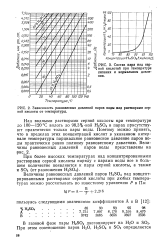 |
Зависимость равновесных давлений паров воды над растворами серной кислоты от температуры. [31] |
Над водными растворами серной кислоты цри температуре до 100 - 120 С вплоть до 98 3 % - ной H2SO4 в парах присутствуют практически только пары воды. Поэтому можно принять, что в пределах этих концентраций кислот в указанном интервале температуры парциальное равновесное давление паров воды практически равно полному равновесному давлению. [32]
В водных растворах серной кислоты деструкция пленок полиарилата Ф-2 толщиной 45 5 мкм происходит во внутренней диф-фузионнокинетической области, однако при высоких температурах ( 130 С) процесс деструкции уже через час переходит во внутреннюю кинетическую область. [33]
 |
Последовательное соединение источников в батарею. [34] |
Электролитом служит водный раствор серной кислоты. Напряжение на зажимах свинцового аккумулятора сразу после заряда достигает 2 7ч - 2 8 В. [35]
Среда - водные растворы серной кислоты ( 10 - 70 %), температура до 60 С. [36]
Вода и водные растворы серной кислоты и сульфата аммония каждый в отдельности не проявляют большой селективности при реэкстракции тантала и ниобия из циклогоксанона. Хотя тантал этими жидкостями вымывается в меньшей степени, чем ниобий, извлечение его в водную фазу за одну промывку составляет 2 - 3 % и более. Вследствие этого ниобий в водной фазе получается со значительной примесью тантала. [37]
Электролит представляет собой водный раствор серной кислоты. Он расходуется в реакции разряда, и его количество должно быть таким, чтобы не только обеспечивалось протекание реакции разряда, но и была достаточно высокой проводимость разряженного аккумулятора. Чем выше концентрация используемой кислоты, тем легче элемент; однако при очень высоких концентрациях уменьшается электропроводность и повышается точка замерзания. Это позволяет очень просто определять степень заряженности элемента. [38]
Температура кипения водных растворов серной кислоты с повышением их концентрации от 0 до 98 33 % повышается. [39]
При получении водных растворов серной кислоты, кроме теплоты образования, выделяется также теплота разбавления серной кислоты водой. Выделение тепла происходит и при смешении кислот различных концентраций. [40]
При нагревании водных растворов серной кислоты состав получающейся газовой фазы и состав жидкой фазы неодинаковы - газовая фаза содержит больше воды, чем жидкая ( см. рис. 1 - 3, стр. Поэтому при нагревании водных растворов серной кислоты в газовую фазу переходит больше паров воды, чем серной кислоты, в результате чего концентрация H2SO4 повышается. Соотношение концентрации серной кислоты в газовой и в жидкой фазах может быть рассчитано по величинам общего давления паров и давления насыщенного пара серной кислоты и водяных паров [ см. уравнение ( 1 - 5) и значения коэффициентов А и Б, стр. [41]
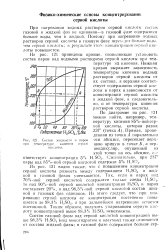 |
Состав жидкости и паров при / температуре кипения серной. [42] |
При нагревании водных растворов серной кислоты состав газовой и жидкой фаз не одинаков - в газовой фазе содержится больше воды, чем в жидкой. Поэтому при нагревании водных растворов серной кислоты в газовую фазу переходит больше воды, чем серной кислоты; в результате этого концентрация серной кислоты повышается. [43]
При нагревании водных растворов серной кислоты состав получающейся газовой фазы и состав жидкой фазы неодинаковы - газовая фаза содержит больше воды, чем жидкая ( см. рис. 1 - 3, стр. Поэтому при нагревании водных растворов серной кислоты в газовую фазу переходит больше паров воды, чем серной кислоты, в результате чего концентрация H2SO4 повышается. Соотношение концентрации серной кислоты в газовой и в жидкой фазах может быть рассчитано по величинам общего давления паров и давления насыщенного пара серной кислоты и водяных паров [ см. уравнение ( 1 - 5) и значения коэффициентов А и Б, стр. [44]
При нагревании водных растворов серной кислоты сначала из них испаряется вода, вследствие чего концентрация кислоты повышается. Над 80-процентной кислотой в газовой фазе появляются пары серной кислоты, количество которых при дальнейшем концентрировании раствора увеличивается. [45]
Страницы: 1 2 3 4