Водный раствор - соединение
Cтраница 1
Водный раствор соединения, не растворимого в эфире, дает кислую реакцию на лакмус. [1]
Водные растворы соединений H2R обладают слабыми кислотными свойствами. [2]
Водные растворы соединений галогенов с водородом являются сильными кислотами. [3]
Водные растворы соединений германия с хлоридом диоксихроменола подчиняются закону Бера до концентрации германия, равной 2 мкг / мл. [4]
Водный раствор соединения кобальта с ПАН имеет максимум светоло; глощения при 585 ммк. Для определения 5 мкг и менее кобальта [721] к анализируемому раствору при рН 5 - 6 прибавляют 0 3 мл 0 1 % - ного этанольного раствора ПАН, выдерживают 5 мин. [5]
Водный раствор ванилинбисульфит-ного соединения направляется в следующий аппарат 13 аналогичного устройства, где разлагается серной кислотой. [6]
Водные растворы соединений трехвалентного титана окрашены в фиолетовый цвет; они неустойчивы, обладают восстановительными свойствами ( хранение без доступа воздуха либо в атмосфере инертного газа или С02), легко окисляются до четырехвалентного титана. Благодаря восстановительным свойствам растворы солей трехвалентного титана используются в титанометрии. [7]
 |
Примеры экстракции солей металлов растворителями. [8] |
Когда водный раствор соединения металла приводится в равновесие с не смешивающимся с водой органическим растворителем, а затем две фазы разделяются, то это соединение распределяется между фазами. Коэффициент распределения зависит от природы растворителя, температуры и состава водной и органической фаз, но не зависит от объема каждой фазы. [9]
Электролиз водных растворов соединений алюминия невозможен, так как ион А13 более активен, чем ион Н3О, и на катоде из водных растворов соединений алюминия будет выделяться водород. [10]
Химия водных растворов соединений циркония более широко развита, поскольку они проявляют меньшую тенденцию к полному гидролизу. Во всяком случае, сомнительно, чтобы акво-ион Zr4 существовал даже в очень кислых растворах. Гид-ролизованному иону часто приписывают структуру цирконил-иона ZnO2, но двойная связь ZrO не существует. Кроме того, каждый из них связан с четырьмя молекулами воды. Таким образом каждый из атомов циркония связан с восемью атомами кислорода, образующими искаженный додекаэдр. [11]
В водных растворах соединения трех - и пятивалентного урана неустойчивы и легко окисляются до соединений четырех - и шестивалентного урана. Ион U4 относительно стабилен в водном растворе. Растворимыми солями четырехвалентного урана являются: сульфат, хлорид, бромид, перхлорат, ацетат. Сульфат урана наиболее устойчив, водные растворы других солей четырехвалентного урана на воздухе неустойчивы и легко окисляются, в связи с чем ион U4 является сильным восстановителем. [12]
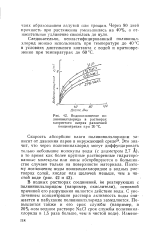 |
Водопоглощение поливинилхлорида в растворах хлористого натрия различной концентрации при 20 С. [13] |
В водных растворах соединений, не реагирующих с поливинилхлоридом ( например, окислители), основной причиной его разрушения является действие воды. С увеличением концентрации раствора активность воды снижается и набухание поливинилхлорида замедляется. [14]
В водных растворах соединения протактиния очень легко гидролизуются, образуя коллоидные растворы. [15]
Страницы: 1 2 3 4