Водный раствор - соль - цинк
Cтраница 1
Водные растворы солей цинка и кальция при применении их в качестве растворителя имеют те же преимущества и недостатки, что и растворы роданида натрия. [1]
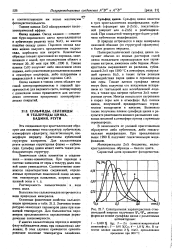 |
Спектральная характеристика относительной энергии излучения IFji / ITn, люминофоров на основе сульфида цинка с различными. активаторами.. [2] |
Поликристаллический сульфид цинка получают обычно из водных растворов солей цинка осаждением сероводородом или сернистыми натрием, аммонием либо барием. МОно кристаллы выращивают из расплава, сублимацией ZnS при 1500 С в атмосфере, содержавшей примесь HzS, а также путем реакции взаимодействия паров цинка и сероводорода или серы. Тонкие пленки сульфида цинка могут быть получены его вакуумным испарением из танталовой или молибденовой лодочек: а также при нагреве таблеток ZnS электронным лучом. Иногда используют нагревание в парах серы или в атмосфере HjS пленки цинка, полученной, предварительно термическим испарением в вакууме. Возможно также получение пленок сульфида цинка в результате реактианого. [3]
В качестве примера можно привести электролиз водных растворов солей цинка: выделению цинка на катоде непременно сопутствует выделение водорода. [4]
Поликристаллический сульфид цинка получают обычно из водных растворов солей цинка осаждением сероводородом либо сернистыми натрием, аммонием или барием. [5]
Как можно объяснить, почему цинк, выделяющийся при электролизе водного раствора соли цинка, обладает повышенной хрупкостью. [6]
При смешивании 0 002 % - ного спиртового раствора реагента с водным раствором соли цинка появляется яркая синяя или светло-синяя люминесценция. Ионы алюминия, борной кислоты, кадмия, кальция, лантана и циркония также образуют люминесцирующие соединения. Однако, в отличие от цинка, их люминесценция легко гасится после добавления 3 % - ного раствора NaF. Исключение составляет кадмий в больших концентрациях: люминесценция не исчезает и после добавления фторида натрия. Окрашенные ионы, например, железа ( III), меди, хрома и др. понижают чувствительность открытия цинка. [7]
Результаты опытов на лабораторных установках показали, что цинк является весьма многообещающим ингибитором коррозии. Так как водные растворы солей цинка до некоторой степени коррозионно активны, то был предпочтен метод суспендирования окиси цинка в топливе. Концентрат, содержащий 20 % окиси цинка в испытуемом топливе ( № 3), дозировался в топливную систему на приеме главного насоса. Результаты приведены на фиг. И совместно с результатами для магния, упоминавшегося ранее; все приведенные данные относятся к введению добавки в топливную линию. Можно видеть, что окись цинка не дает таких хороших результатов в отношении уменьшения коррозии, как ацетат магния, хотя при сравнении следует учитывать различия в температурах и атомных отношениях. С учетом хлопьевидной природы отложений различия в этом отношении были признаны незначительными. Было найдено, что применение суспензии твердого ингибитора в топливе приводит к некоторым осложнениям в работе системы подачи топлива. [8]
Как правило, интересующие нас вещества непосредственно недоступны и должны быть приготовлены из тех или иных исходных материалов. Например, германий получают путем восстановления двуокиси германия водородом; сульфид цинка осаждают из водных растворов солей цинка сероводородом, сульфидом аммония или же готовят из цинка и серы в жидкой или паровой фазе. [9]
 |
Схема прибора. [10] |
Ионы на электродах разряжаются. При одновременном нахождении в растворе катионов нескольких металлов на катоде будет разряжаться в первую очередь тот, который имеет большую алгебраическую величину электродного потенциала, следовательно, при одновременном нахождении в растворе ионов Н и катионов металлов, стоящих в ряду напряжений после водорода, разряжаться будут последние, тогда как катионы Н будут оставаться в растворе. При электролизе водных растворов солей металлов, стоящих в ряду напряжений до водорода, должны разряжаться ионы Н и оставаться в растворе катионы металлов. Так, при электролизе водных растворов солей цинка, железа, свинца и некоторых других металлов, стоящих в ряду напряжений хотя и левее водорода, но близко к нему, на катоде выделяются эти металлы. [11]
Очень часто восстановление металла осложняется сопутствующим ему восстановлением других металлов ( примесей) или водорода. Это явление имеет большое практическое значение. Вопросы электролитической рафинировки металлов ( очистка от примесей), вопросы гальваностегии и многие Другие связаны с проблемой одновременного восстановления нескольких различных катионов. В качестве примера можно привести электролиз водных растворов солей цинка: выделению цинка на катоде непременно сопутствует выделение водорода. [12]
Очень часто восстановление металла осложняется сопутствующим ему восстановлением других металлов ( примесей) или водорода. Это явление имеет большое практическое значение. Вопросы электролитической рафинировки металлов ( очистка от примесей), вопросы гальваностегии и многие другие связаны с проблемой одновременного восстановления нескольких различных катионов. В качестве примера можно привести электролиз водных растворов солей цинка: выделению цинка на катоде непременно сопутствует выделение водорода. [14]
Страницы: 1
