Водный раствор - сульфит
Cтраница 2
По этому способу SO2 извлекается из предварительно охлажденных и очищенных от золы дымовых газов охлажденным водным раствором сульфита аммония. [16]
Нафтиламин получают по методу, разработанному Бухерером1 ( 1904), заключающемуся в нагревании р-нафтола с водным раствором сульфита или бисульфита аммония. [17]
Для определения Se применяют весовой метод - выделение его в элементарном состоянии при помощи газообразного SO2 или водного раствора сульфита или гидразина. [18]
По методу, разработанному Сэгером1 ( 1961), 30 % - ный раствор технического глиоксаля прибавляют к водному раствору сульфита и бикарбоната натрия и пропускают через раствор сильную струю воздуха. [19]
Кето-енольная таутомерия лежит в основе замещения фенольного гидроксила на аминогруппу, которое происходит при нагревании 1 - или 2-гидроксинафталина, сульфопронзводных а - и р-нафголов, 6 - или 8-гидроксихинолинов и других гидроксипронзводных нафталина, антрацена, хинолина с водным раствором сульфита или гидросульфита аммония при 130 - 150 С. [20]
Все сульфиты, за исключением сульфитов щелочных металлов, нерастворимы в воде. При действии серы на водные растворы щелочных сульфитов образуются тиосульфата ( М2 520д), большинство которых растворимы в воде. [21]
Одним из таких малотоннажных производств может стать процесс переработки ОСК установки Парекс с получением высококачественной серной кислоты и сульфокарбоксильного катионита [ II ], используемого для умягчения и очистки технической воды, а также в земледелии, животноводстве и в качестве наполнителя при изготовлении белкового обогатителя кормов. Смесь сульфокарбоксильного катионита с водным раствором сульфита аммония может быть использована также в качестве мелиоранта и обогатителя почвы азотом и гумино-выми соединениями. [22]
Обе реакции приводят к образованию сульфата аммония. Проблема окисления S02 в водном растворе сульфита - бисульфита аммония детально изучалась [27]; в результате этих исследований была установлена возможность подавления этих реакций галловой кислотой, таннином, пирогаллолом и некоторыми другими восстановителями. Однако разработанные до настоящего времени процессы этого типа обычно основываются в большей мере на удалении сульфата аммония из системы, чем на предотвращении его образования. [23]
Этот процесс был разработан на металлургическом заводе Коминко ( Консолидейтед майнинг энд смелтинг компани) в Трейле, Канада, для абсорбции S02 из отходящих газов различных процессов цветной металлургии и сернокислотной установки. Процесс основывается на абсорбции S02 водным раствором сульфита аммония и выделении ( десорбции) сернистого ангидрида добавкой серной кислоты к раствору с образованием сульфата аммония в качестве побочного продукта. Этот процесс использован также для очистки отходящих газов сернокислотного производства на заводе Олин-Матисон в Пасадене. [24]
Фридман и Либби в течение часа облучали тепловыми нейтронами жидкий и твердый бромистый изопропил, а также нормальный бромистый пропил, которые в некоторых опытах содержали растворенный бром. После облучения бромистый пропил немедленно подвергался экстрагированию водным раствором сульфита с ионами брома в качестве носителя, поскольку при длительном стоянии облученного раствора наблюдалось невоспроизводимое увеличение неизвлекаемой части активности в форме галогенного органического соединения, связанное, повидимому, с протеканием тепловых или фотохимических реакций замещения. [25]
Реакция Бухерера протекает при нагревании нафтолов с водными растворами сульфита и аммиака. Эта реакция обратима и может быть направлена в ту или другую сторону в зависимости от условий. [26]
Поэтому были разработаны два метода очистки дымовых газов от двуокиси серы. Один метод заключается в промывке дымовых газов водным раствором сульфита аммония, что приводит к образованию дисульфита аммония, который после десорбции паром дает обратно двуокись серы. Восстановленный раствор сульфита аммония снова подается в промывную башню, в то время как двуокись серы компремируется и сжижается. Нежелательное окисление сульфита предотвращают добавлением антиокислителя и проведением очистки при более низкой температуре. [27]
Так, имеется качественное доказательство комплексообразования плутония ( IV) с с у л ь-ф и т-и оном. Пероксид плутония ( IV) легко растворяется в водном растворе сульфита аммония при комнатной температуре. Спектрофотометрические наблюдения показывают, что существует по меньшей мере два сульфитных комплекса и что SO - ион является более сильным комплексообразователем, чем ионы С1 - и SOj, но более слабым, чем карбонат и цитрат. Качественное доказательство цитратного компле к с ообразования плутония ( IV) получено при ионообменных исследованиях. В 0 05 М растворе лимонная кислота-цитрат при рН 2 примерно 50 % плутония ( IV) находится в виде комплексных анионов. Прибавление ацетата к раствору плутония ( IV) вызывает изменение его окраски: от коричнево-зеленого до пурпурно-оранжевого. Из растворов с концентрацией ацетатного комплекса плутония ( IV) более 0 1 М выпадает розовая основная соль. Существование отрицательно заряженных ацетатных комплексов обнаружено электромиграционным методом, а изменения спектра поглощения плутония ( IV) при добавлении ацетата в дальнейшем подтвердили образование таких комплексных ионов. Образование карбонатных комплексов плутония ( IV) установлено чисто качественно. [28]
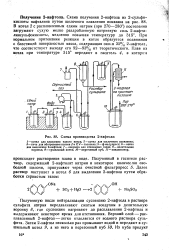 |
Схема производства 2-нафтола. [29] |
Полученную после нейтрализации суспензию 2-нафтола в растворе сульфита натрия передавливают сжатым воздухом в делительную воронку 8: где суспензию нагревают до расплавления 2-нафтола и выдерживают некоторое время для отстаивания. Верхний слой - расплавленный 2-нафтол - легко отделяется от водного раствора сульфита. [30]
Страницы: 1 2 3