Водный раствор - даюта
Cтраница 2
Обладающие низким молекулярным весом сложные эфиры муравьиной и пировиноградной кислот гидролизуются в присутствии воды при комнатной температуре; это доказывается тем, что их водные растворы дают определенно кислую реакцию на лакмус. [16]
Соединения, очень мало диссоциирующие, как ШО, tbS, РЬ ( СгНзО2) 2, или соединения очень мало растворимые, как А1 ( ОН) з, PbSCu, в водном растворе дают лишь очень малую концентрацию ионов; формулы их пишут в недиссоциированной или в молекулярной форме, потому что ббльшая часть такого вещества присутствует в растворе в виде молекул. [17]
Их водные растворы дают реакцию на анион галогена, что подтверждает ионный характер связи катиона тропилия с неорганическим анионом. [18]
Слабощелочную реакцию водного раствора дают аминокислоты, в молекуле которых преобладает число аминогрупп. Слабокислую реакцию водного раствора дают аминокислоты, в молекуле которых преобладает число карбоксильных групп. [19]
В присутствии спиртов появляется красная окраска. Фенолы в водном растворе дают зеленовато-коричневый или коричневый осадок, а в диоксане - темно-красное или коричневое окрашивание. [20]
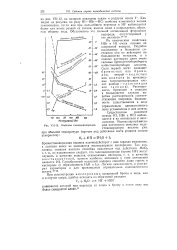 |
Свойства галоидоводородов. [21] |
По химическим свойствам НВг и HI очень похожи на хлористый водород. Подобно последнему в безводном состоянии они не действуют на большинство металлов, а в водных растворах дают очень сильные бромистоводороднуюи иодистоводо родную кислоты. Растворимость бромидов и иодидов в большинстве случаев подобна растворимости соответствующих хлоридов. Возможность существования в виде отрицательно одновалентного иона установлена и для астата. [22]
По химическим свойствам НВг и HI очень похожи на хлористый водород. Подобно последнему, в безводном состоянии они не действуют на большинство металлов, а в водных растворах дают очень сильные бромистоводородную и иодистоводородную кислоты. Растворимость бромидов и иодидов в большинстве случаев близка к растворимости соответствующих хлоридов. Существование в виде отрицательно одновалентного иона характерно в растворах и для астата. [23]
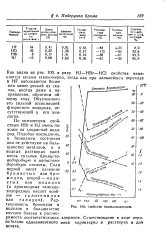 |
U. Свойства галоидоводородов. [24] |
По химическим свойствам НВг и HJ очень похожи на хлористый водород. Подобно последнему, в безводном состоянии они не действуют на большинство металлов, а в водных растворах дают очень сильные бромисто-водородную и иодистояо-дородную кислоты. Растворимость бромидов и иодидов в большинстве случаев близка к растворимости соответствующих цательно одновалентного астата. [25]
Диссоциация воды, несмотря на ее малое значение, оказывает существенное влияние на свойства растворов электролитов. Примером такого влияния служит явление гидролиза, заключающееся в том, что соли слабых кислот в водном растворе дают щелочную реакцию среды, а соли слабых оснований - кислую реакцию. В общем, гидролиз ( буквально разложение водой) - реакции обменного разложения между водой и различными веществами. [26]
Из этих данных можно заключить, что N-бром -, так же как я N-хлорсоединения амидов кислот могут быть получены необработкой последних водными растворами бром-и хлорноватистой кислот. С другой стороны, становится понятным тот факт, что многие N-бром, N-хлор - и М - иодсоединеиия при лабильности, возрастающей от хлора к иоду, в водном растворе дают реакцию хлорноватистой, бромноватистой и иоднова-тистой кислот. Реакция образования N-галоидных соединений из ациламина и хлор -, бром -, иодноватистой кислот является обратимой. [27]
Галоидозамещенные спирты обладают уже кислотными свойствами: трихлорэтиловый спирт мало растворим в воде, легко - в щелочи, а дифторэтиловый спирт разлагает раствор поташа и реагирует с едким натром, окисями кальция и стронция с образованием алкоголятов. Цианкарбинол ( нитрил гликолевой кислоты) является кислотой ( / CtE 0.8i 10 - 5), что соответствует высокому дипольному моменту связи С-CN. Эти спирты растворяют в водном растворе окиси кальция, стронция, бария, свинца и даже висмута. Константа диссоциации пентоз колеблется около 3.7 - 7.2 10 - 13, гек-соз ( лишний гидроксил) - около 6.6 - 10.9 10 - 13, и эти моносахариды в водном растворе дают сахараты многих щелочноземельных и тяжелых металлов. Фенол ( 1.3 10 - 10) растворяется в щелочи, пентахлор-фенол разлагает раствор соды, а тринитрофенол является сильной кислотой. В моногидратах трикетонов два гидро-ксила 1 1-диола расположены между двумя высокополярными кето-группами, протонизующими водороды гидроксилов. В пентагидрате циклонентанпентона ( лейконовая кислота) углеродный скелет несет только отрицательные группы ( гидроксилы) и не имеет водородных атомов, и 10 гидроксилов взаимопротонизуют друг друга. То же имеет место и в случае гидрата циклогексангексона. В обоих этих случаях энолизация невозможна, так как в этих частицах отсутствуют атомы водорода, связанные с углеродами. [28]
Страницы: 1 2