Нейтральный водный раствор
Cтраница 3
В этом разделе рассматриваются только нейтральные водные растворы с высокой электрической проводимостью, содержащие ионы галоидных соединений. [31]
Обратимый разряд кислорода из нейтрального водного раствора, где концентрация ионов ОН значительно ниже, может происходить при анодном потенциале 0 82 вольта. Выделение кислорода на аноде, однако, сопровождается весьма высоким перенапряжением, которое даже на платинированной платине и при умеренной плотности тока достигает 1 вольта, в результате чего анодный потенциал для разряда кислорода будет около 1 8 вольта. [32]
Обратимое выделение водорода из нейтрального водного раствора требует катодного потенциала, равного 0 4 вольта. При низкой плотности тока, например 100 а / м2, у ртутного катода перенапряжение составляет около 1 вольта. При этих условиях будет происходить разряд ионов водорода, но не ионов натрия, так как перенапряжение водорода на концентрированной натровой амальгаме значительно ниже, чем на чистой ртути. Но если плотность тока возросла, и вместе с этим увеличилось перенапряжение водорода, разряд ионов Н будет менее легким, и если ртуть непрерывно протекает с такой скоростью, при которой получается амальгама небольшой концентрации, то будет происходить главным образом разряд ионов Na при ничтожном количестве выделяющегося водорода. [33]
К 2 0 мл нейтрального водного раствора, содержащего 0 5 - 2 0 мкг Li, добавляют 0 01 мл КОН, 3 мл 0 02 % - ного раствора дибензотиазолилметана в диоксане, разбавляют до 10 мл диоксаном и наблюдают флуоресценцию. [34]
Борьба с коррозией в нейтральных водных растворах может осуществляться различными методами: 1) применением протекторной защиты, 2) обработкой воды с целью удаления растворенного кислорода, 3) созданием на поверхности различных защитных покрытий. [35]
Гидролиз тростникового сахара в нейтральном водном растворе практически не идет: его ускоряют прибавлением в качестве катализатора сильной ( то есть хорошо ионизированной) кислоты. Константу скорости реакции вычисляют по уравнению ( XVII. [36]
Некоторые из галогенат-ионов в нейтральных водных растворах не проявляют сильных окислительных свойств, которые можно было бы ожидать на основании величин их потенциален. [37]
Диметоат довольно устойчив в кислых и нейтральных водных растворах при комнатной температуре, а в щелочных средах он очень быстро гидролизует-ся. В табл. 63 приведено время гидролиза 50 % диметоата при температуре 70 и рН 1 - 9; для сравнения приведены соответствующие данные для паратиона. [38]
Для предотвращения коррозии металлов в нейтральных водных растворах в последнее время широко применяются органические ингибиторы. [39]
Щелочные соли феннлтиосерной кислоты ь нейтральном водном растворе устойчивы. При обычной температуре феннлтиссерная кислота устойчива также и в кислом растворе. [40]
Щелочные соли фенилтиосерной кислоты в нейтральном водном растворе устойчивы. При обычной температуре феиилтиосерная кислота также устойчива и в кислом растворе. [41]
Поскольку последний образуется только в нейтральных водных растворах, процесс димеризации, вероятно, связан с образованием биполярного иона, о котором упоминалось выше ( стр. В пользу этого предположения Гаррисом были приведены важные доказательства. [42]
Щелочные соли фенплтиосерной кислоты Б нейтральном водном растворе устойчивы. При обычной температуре фенилтиосерная кислота устойчива также и в кислом растворе. [43]
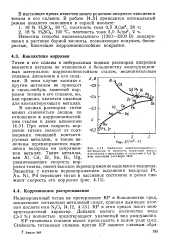 |
Величина электрохимически. и потенциала и скорость коррозии титана в контакте с металлами и сплавами в 7 5 % - ном кипящем растворе НС1. [44] |
Титан и его сплавы в нейтральных водных растворах хлоридов являются катодом по отношению к большинству конструкционных материалов: коррозионностойким сталям, медноникелевым сплавам, алюминию и его сплавам. В этом случае контакт с другим металлом не приводит к сколь-нибудь заметной коррозии титана и его сплавов, но, как правило, является опасным для контактирующего металла. При этом скорость коррозии титана зависит от соотношения площадей контакти-руемых металлов, а также величины перенапряжения выделения водорода на сопряженном металле. Такие металлы, как Al, Cd, Zr, Sn, Bi, Hg, увеличивающие скорость коррозии титана, имеют высокое перенапряжение выделения водорода. [45]
Страницы: 1 2 3 4