Растворение - известняк
Cтраница 2
Получение хлорида кальция этим методом заключается в растворении известняка в соляной кислоте, в очистке образующегося сырого ( неочищенного) раствора СаС12 от примесей и в обезвоживании его. Продукт получается более чистым, чем из отходящих жидкостей содового или хлоратного производства. [16]
Получение хлорида кальция этим методом заключается в растворении известняка в соляной кислоте, очистке образующегося раствора от содержащихся в нем солей железа, магния, алюминия, сульфат-ионов и его обезвоживании. [17]
Получение хлорида кальция этим методом заключается в растворении известняка в соляной кислоте, в очистке образующегося сырого ( неочищенного) раствора СаС12 от примесей и в обезвоживании его. Продукт получается более чистым, чем из отходящих жидкостей содового или хлоратного производства. [18]
Получение хлорида кальция этим методом заключается в растворении известняка в соляной кислоте, в очистке образующегося сырого ( неочищенного) раствора СаСЬ от примесей и в обезвоживании его. [19]
Поступают ионы кальция в природные воды при растворении известняков и гипса. Растворение известняков, а также содержащих кальций алюмосиликатов происходит под действием присутствующей в воде углекислоты. Реакция эта обратима, концентрация образующихся тидрокарбонатных ионов зависит, как отмечалось выше, от содержания в воде равновесной углекислоты; при уменьшении ее количества протекает обратный процесс выделения в осадок нерастворимого карбоната кальция. Такие явления наблюдаются при выходе на поверхность богатых Са ( НСО3) а подземных вод с образованием туфов. Карбонат кальция расходуется на построение скелетов морских организмов, которые после отмирания опускаются на дно, образуя мощные отложения извест-няков. [20]
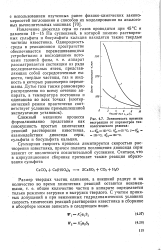 |
Зависимость времени экстракции от параметров технологического режима. [21] |
Сложный механизм процесса формализованно представим как совокупность простых химических реакций растворения известняка, взаимодействия диоксида серы, сульфита и бисульфита кальция. [22]
Хлорид кальция, предназначенный для производства металлического кальция, получают растворением известняка в соляной кислоте или абсорбцией абгазного хлора известковым молоком. К исходному сырью предъявляют повышенные требования. [23]
Растворение известняка быстрее происходит выше зеркала грунтовых вод, где идет обильное в: быстрое - движение просачивающейся воды и где циркулирующие воды содержат углекислоту, необходимую для растворения известняка. Очевидно, что идеальным стечением обстоятельств будет такое, когда известняк сначала, находясь в условиях благоприятных для выщелачивания, становится кавернозным, а затем благодаря перемене условий, вызывающей поднятие водного зеркала, кавернозная часть оказывается погруженной в зону насыщения. [24]
В результате описанного процесса на забое скважины образуется довольно концентрированный водный раствор хлористого натрия, который при контакте с раствором хлористого кальция и магния, образующимся в результате растворения известняков в НС1, может частично выпасть в кристаллический осадок. [25]
На земной поверхности происходит с одной стороны растворение карбонатов в кислых и нейтральных условиях среды - выщелачивание карбонатного цемента в зернистых породах, конкреций в глинистых и других породах, растворение известняков, доломитов и других карбонатных пород. [26]
Кларк, исходя из площадей, занимаемых на земной поверхности изверженными и огадочными породами, и процентного содержания в последних известняков, пытался разделить количество НСО на две части: происшедшую от растворения известняков и на образовавшуюся при выветривании. Оценив приблизительно площади, занимаемые известняками ( 5 % осадочных пород и 3 75 % всей площади), и результаты их анализов, он считал необходимым вычесть из величины стока ионов СО около 25 % содержания СО как перешедшие из атмосферы при выветривании. Однако подобный прием не учитывает кинетики процессов растворения известняков и выветривания, которая, несомненно, различна. [27]
Поступают ионы кальция в природные воды при растворении известняков и гипса. Растворение известняков, а также содержащих кальций алюмосиликатов происходит под действием присутствующей в воде углекислоты. Реакция эта обратима, концентрация образующихся тидрокарбонатных ионов зависит, как отмечалось выше, от содержания в воде равновесной углекислоты; при уменьшении ее количества протекает обратный процесс выделения в осадок нерастворимого карбоната кальция. Такие явления наблюдаются при выходе на поверхность богатых Са ( НСО3) а подземных вод с образованием туфов. Карбонат кальция расходуется на построение скелетов морских организмов, которые после отмирания опускаются на дно, образуя мощные отложения извест-няков. [28]
Кислотная обработка является методом увеличения выхода скважины за счет закачивания кислоты непосредственно в продуктивный пласт для открытия протоков в результате реакции между химикатами и минералами. Первоначально для растворения известняков использовалась соляная кислота. Она до сих пор наиболее широко применяется для этих целей. Однако теперь для управления реакцией, а также для предупреждения коррозии и образования эмульсий к соляной кислоте добавляются различные химикаты. [29]
СО; концентрация только последнего иона входит в выражение для произведения растворимости среднего карбоната, и, следовательно, большее количество карбоната может раствориться в кислом растворе, чем в нейтральном или щелочном растворе, до того как произведение концентраций ионов станет равным произведению растворимости данного карбоната. Именно этим объясняется растворение известняка кислой грунтовой водой; количественная сторона данного явления рассмотрена в следующем разделе. [30]
Страницы: 1 2 3