Растворение - никелевый анод
Cтраница 1
Растворение никелевых анодов сопровождается значительной поляризацией, вследствие чего на никеле выделяется кислород, который взаимодействует с его поверхностью, образуя на ней окисные и гидроокисные соединения никеля, и растворение анодов резко замедляется или прекращается совершенно. Внешним признаком пассивности анодов является сильное потемнение их поверхности. Во время работы на анодах наблюдается сильное выделение кислорода, а иногда и хлора. [1]
Для лучшего растворения никелевых анодов в электролит вводят в небольших количествах иоиы хлора в виде хлористого натрия, хлористого калия или хлористого никеля. [2]
В ходе растворения никелевых анодов наблюдается значительная поляризация их вследствие пассивирования. Аноды покрываются сплошной солевой или оксидной пленкой и растворение никеля сильно замедляется, так как на аноде начинается процесс выделения кислорода. В результате концентрация никеля в растворе постепенно снижается, раствор подкисляется, что приводит к нарушению нормального процесса электролиза. [3]
В ходе растворения никелевых анодов наблюдается значительное повышение потенциала вследствие пассивирования. Аноды покрываются сплошной солевой или оксидной пленкой, и растворение никеля сильно замедляется, так как на аноде начинается процесс выделения кислорода. В результате концентрация никеля в растворе постепенно снижается, раствор подкисляется, что приводит к нарушению нормального процесса электролиза. [5]
Активирующее действие хлоридов на растворение никелевых анодов объясняется специфической адсорбцией хлорид-ионов, в результате чего с поверхности никеля удаляются кислород, гидроксил-ионы и другие пассивирующие ее чужеродные частицы. [7]
Активирующее действие хлоридов на растворение никелевых анодов объясняется спедифической адсорбцией хлор-ионов, в результате чего с поверхности никеля удаляются кислород, гидрок-сильные - ионы и другие пассивирующие ее чужеродные частицы. [8]
Наступающая пассивность тормозит процесс растворения никелевого анода в гальванотехнике. [9]
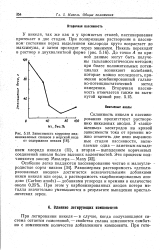 |
Зависимость коррозии мед. [10] |
Склонность никеля к пассивированию препятствует растворению никелевых анодов. [11]
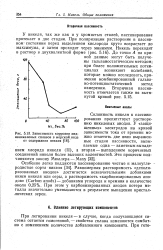 |
Зависимость коррозии мед. [12] |
Склонность никеля к пассивированию препятствует растворению никелевых анодов. [13]
Процесс образования ионов никеля при растворении никелевого анода протекает с пониженной скоростью, которая увеличивается с повышением температуры раствора. При потенциале 0 35 в наступает анодная пассивность. Сила тока, при которой наступает пассивность, зависит от рН раствора. [15]
Страницы: 1 2 3