Растворение - медь
Cтраница 3
Так, процесс растворения меди в азотной кислоте, кинетика которого вообще весьма сложна, посредством добавления нитрита и перекиси водорода удалось перевеети в чисто диффузионную область. В таких условиях он становится удобным модельным процессом для изучения переноса вещества. Процесс этот удобен тем, что для него легко создать совершенно определенную гидродинамическую обстановку. [31]
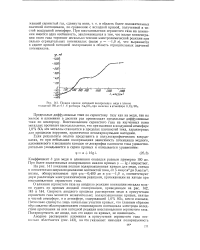 |
Полная кривая катодной поляризации меди в пленке толщиной 160 лк 0 1. V раствора Na2SO при наличии в атмосфере 0 1 % SO2. [32] |
Скорость анодного процесса растворения меди в присутствии сернистого газа меняется незначительно; поляризационные кривые, снятые в чистой атмосфере, и в атмосфере, содержавшей 1 0 % SO2, почти совпали. Несколько сдвинуты лишь начальные участки кривых, что главным образом обусловлено облагораживанием стационарного потенциала электрода вследствие протекания на нем катодной реакции восстановления сернистого газа. Поляризуемость же анода, как это видно из кривых, не изменилась. [33]
Однако электрохимический процесс растворения меди вполне возможен при окислительной деполяризации катодов, например, при наличии кислорода воздуха в растворе. Потенциал меди для большинства условий хорошо подчиняется зависимости Нернста от концентрации собственных ионов. В, т.е. менее положителен, чем стандартный равновесный потенциал меди. Это объясняется более низкой концентрацией ионов меди в приэлектродном слое коррозионного раствора по сравнению с их концентрацией при установлении нормального равновесного потенциала меди. [34]
На медных анодах происходит растворение меди с образованием двухвалентных и одновалентных ионов меди, возможно также окисление одновалентных ионов в двухвалентные. На медных катодах происходит разряд ионов меди с выделением металла. [35]
Примером автокатализа может служить растворение меди в азотной кислоте; при этом катализатором является образуемый в результате реакции оксид азота. Другим примером автокатализа может служить реакция взаимодействия перманганата калия в сернокислой среде со щавелевой кислотой или ее солями ( уравнение реакции см. стр. Образующиеся в результате реакции ионы марганца Мп2 катализируют реакцию. Эта реакция широко используется в качественном и количественном анализе. [36]
В этих условиях возможно растворение меди и выделение цинка. [37]
Примером автокатализа может служить растворение меди в азотной кислоте; при этом катализатором является образуемый в результате реакции оксид азота. Другим примером автокатализа может служить реакция взаимодействия перманганата калия в сернокислой среде со щавелевой кислотой или ее солями ( уравнение реакции см. с. Образующиеся в результате реакции ионы марганца Мп2 катализируют реакцию. Эта реакция широко используется в качественном и количественном анализе. [38]
Примером автокатализа может служить растворение меди в азотной кислоте, при этом катализатором является образуемый в результате реакции окисел азота. Другим примером автокатализа может служить реакция взаимодействия перман-ганата калия в сернокислой среде со щавелевой кислотой или ее солями ( уравнение реакции - см. стр. Образующиеся в результате реакции ионы двухвалентного марганца Мп катализируют реакцию. Эта реакция широко используется в качественном и количественном анализе. [39]
Теоретически при обратимом процессе растворения меди на аноде и при выделении ее на катоде разность электродных потенциалов должна быть равна нулю, однако, как указано выше, в этом простом процессе возникают поляризационные явления. [40]
Исследователи, изучавшие процесс растворения меди в других растворителях, а именно: в аммиачном растворе меди22, растворах галоидов23, уксусной кислоте24, а также растворение других металлов в различных растворителях 25 - 26, установили, что скорость растворения металлов находится в зависимости от скорости перемешивания или потока раствора, температуры, концентрации растворителей, присутствия окислителей. Таким образом, процесс растворения меди в соляной кислоте является диффузионным процессом и подчиняется законам кинетики. [41]
Какие факторы ускоряют процесс растворения меди е разбавленной серной кислоте. [42]
Исследователи, изучавшие процесс растворения меди в других растворителях, а именно: в аммиачном растворе меди22, растворах галоидов23, уксусной кислоте24, а также растворение других металлов в различных растворителях 25 - 2В, установили, что скорость растворения металлов находится в зависимости от скорости перемешивания или потока раствора, температуры, концентрации растворителей, присутствия окислителей. Таким образом, процесс растворения меди в соляной кислоте является диффузионным процессом и подчиняется законам кинетики. [43]
Исследователи, изучавшие процесс растворения меди в других растворителях, а именно: в аммиачном растворе меди22, растворах галоидов23, уксусной кислоте24, а также растворение других металлов в различных растворителях 25 26, установили, что скорость растворения металлов находится в зависимости от скорости перемешивания или потока раствора, температуры, концентрации растворителей, присутствия окислителей. Таким образом, процесс растворения меди в соляной кислоте является диффузионным процессом и подчиняется законам кинетики. [44]
Раствор медного комплекса получают растворением однохлори-стой меди в избытке соляной кислоты, при замене части соляной кислоты раствором поваренной соли получают кислую натриевую соль хлормедной кислоты. [45]
Страницы: 1 2 3