Растворение - молибден
Cтраница 1
Растворение молибдена, а также ниобия в никеле сопровождается понижением температуры плавления образующихся сплавов до 1300 и 1265 С соответственно при содержании свыше 40 % легирующего металла. Растворение вольфрама в никеле сопровождается повышением температуры плавления по сравнению с чистым никелем, и для сплавов с 40 % W достигает 1505 С. [1]
Чрезвычайно перспективен для промышленного использования катализатор, получающийся растворением молибдена при нагревании в кубовом остатке продуктов эпоксидирования олефинов. Переходу молибдена в раствор способствует наличие в кубовом остатке как гидроперекисей, так и полигидроксильных соединений. [2]
 |
Схема процесса выделения молибдена из отработанных кислых растворов, образующихся при производстве вольфрамовых нитей накаливания. [3] |
При растворении в кислоте достаточно большого количества молибдена ( - 40 - 75 г / л) скорость растворения молибдена значительно снижается и раствор кислот рассматривается как отработанный. До последнего времени не существовало экономичного процесса выделения молибдена из этого раствора и поэтому он, после соответствующей обработки, направляется в сток. [4]
В современном ламповом производстве для извлечения молибденового керна из тел накаливания применяется процесс химического травления, при котором происходит растворение молибдена из биметаллической системы Mo-W. Процесс химического растворения экологически опасен, так как образуются сильнокислые молибденсо-держащие растворы примерного состава ( % мае. [5]
По аналогии с данными, полученными для железа [35], Цейфанг и Конрад полагают, что упрочнение В-ти-тановых сплавов при растворении молибдена обусловлено главным образом увеличением плотности дислокаций при данной степени деформации. Вместе с тем авторы указывают, что это не более, чем предположение, которое требует эсперименталыюй проверки. [6]
Таким образом, использование центробежного электролизера позволяет улучшить электрический контакт между вольфрамом и молибденом в процессе анодного растворения молибдена из тел накаливания и увеличить скорость растворения молибдена. [7]
Кислота азотная, р 1 43 г / см3 и разбавленная 1: 3; 2) кислота соляная р 1 19 г / см3 и разбавленная 1: 1, 1: 3; 3) кислота серная, р 1 84 г / см3 и разбавленная 1: 1; 4) кислота винная, 20 % - ный раствор; 5) кислота уксусная, р 1 05 г / см3; 6) аммиак водный, 25 % - ный раствор; 7) гидроксид натрия или натр едкий, 25 % - ный раствор; 8) хлорид гидразиния, 20 % - ный раствор, свежеприготовленный; 9) раствор, содержащий в 1 мл 1 мг молибдена ( для его получения 0 500 г металлического молибдена помещают в стакан вместимостью 500мл, приливают 50 - 60мл разбавленной 1: 3 азотной кислоты. После растворения молибдена приливают 30мл разбавленной 1: 1 серной кислоты и нагревают раствор до выделения паров серного ангидрида. Раствор охлаждают, приливают 2 - 3 мл воды и снова нагревают до выделения паров серного ангидрида; снова охлаждают и приливают 100 мл воды. Раствор кипятят 2 - 3 мин, охлаждают, переливают в мерную колбу вместимостью 500 мл, доживают водой до метки и перемешивают); 10) ацетат аммония; 11) ацетатный буферный раствор, рН 5 8 ( для его получения 500 г ацетата аммония растворяют в воде, переводят в мерную колбу вместимостью 1 л, добавляют 20 мл уксусной кислоты, доводят до метки водой и перемешивают); 12) ацетат цинка, 0 01 М раствор ( для его получения 2 195 г соли помещают в мерную колбу вместимостью 1 л, прибавляют 25 мл ацетатной буферной смеси, доливают водой до метки, перемешивают); 13) уротропин, 30 % - ный раствор; 14) бромтимоловый синий ( индикатор), 0 1 % - ный раствор; 15) ксиле-ноловый оранжевый ( индикатор), 0 2 % - ный раствор; 16) комплексен III, 0 01 М раствор. [8]
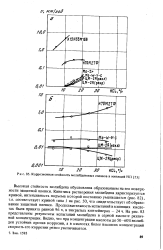 |
Коррозионная стойкость молибденовых сплавов в кипящей НС1. [9] |
Высокая стойкость молибдена обусловлена образованием на его поверхности защитной пленки. Кинетика растворения молибдена характеризуется кривой, интенсивность подъема которой постоянно уменьшается ( рис. 82), т.е. соответствует кривой типа 1 на рис. 50, что свидетельствует об образовании защитной пленки. На рис. 83 представлены результаты испытаний молибдена в серной кислоте различной концентрации. Видно, что при концентрации кислоты до 50 - 60 % молибден устойчив против коррозии, а в кислотах более высоких концентраций скорость его коррозии резко увеличивается. [10]
При растворении молибдена в окислительно-щелочных расплавах образуются молибдаты. [11]
Сплавы молибдена растворяются в кислотах: в концентрированной соляной или серной ( 1: 3) при добавлении азотной кислоты. Удобным способом растворения молибдена и его сплавов с вольфрамом является применение пероксида водорода или насыщенного раствора щавелевой кислоты в присутствии пероксида водорода; растворение происходит при умеренном нагревании раствора. [12]
Процесс переработки ядерного горючего заключается в растворении ТВЭЛ в смеси 5 5 М азотной кислоты и 1 0 М нитрата окис-ного железа. В результате получают раствор, содержащий уран ( 100 г / л) и 3 М азотную кислоту. Ион окисного железа играет роль комплексообразователя и способствует растворению молибдена. Для экстракции применяются пульсационные смесители-отстойники. При высоких концентрациях ТБФ не всегда достигается желаемое насыщение экстрагента и поэтому степень очистки может меняться. Фазы разделяются сравнительно плохо, поэтому экстрагент уносится с водной фазой. Поэтому в схемах, где используется 6 % - ный раствор ТБФ, нет необходимости применять пульсационные колонны или центробежные экстракторы. [13]
В заключение этого раздела необходимо подчеркнуть, что к трактовке аномальных явлений при растворении металлов на основе представления о химическом механизме процесса следует подходить с известной осторожностью. Особенно это относится к растворению металлов при катодной поляризации. Независимость скорости растворения от потенциала в этой области, как указывалось выше, может быть связана, например, с замедленным химическим растворением электрохимически образовавшегося окисла. Поздеева, Антоновская и Сухотин [263], объясняя такую независимость для растворения молибдена в серной кислоте, принимают гипотезу о существовании на этом металле поверхностного слоя с высоким содержанием кислорода. [14]
Анодные кривые для титана и хрома одинаковы. На кривой можно отметить следующие характерные точки: Vcm - стационарный потенциал, внешний ток равен нулю, Vп - потенциал начала пассивации соответствует максимальному току анодного растворения металла. При потенциалах, более положительных, чем потенциал полной пассивации, металл находится в пассивном состоянии, поддерживаемом внешней анодной поляризацией. Различие в анодном поведении титана и хрома состоит в следующем: при высоких положительных потенциалах пассивное состояние титана не нарушается, в то время как у хрома наступает состояние перепассивации [10-12], в котором он начинает растворяться в виде шестивалентных ионов. Потенциал полной пассивации у хрома более отрицательный, чем у титана. Перенапряжение водорода на хроме несколько более низкое, чем на титане. Поэтому в области потенциалов, где титан активно анодно растворяется на молибдене, протекают катодные процессы. Анодное растворение молибдена наблюдается только при значительном смещении его потенциалов в положительную сторону. Сопоставлением весовых потерь и количества пропущенного электричества установлено как в наших опытах, так и в работе [13], что растворение молибдена происходит в виде шестивалентных ионов. Молибден является кор-розионностойким металлом в серной кислоте. [15]
Страницы: 1 2