Растворение - окись
Cтраница 1
Растворение окисей или дигидроокисей триалкилсурьмы в органических кислотах приводит к соответствующими диацилатам. [1]
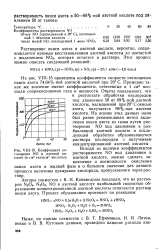 |
Коэффициент поглощения NO в азотной кислоте ( в см3 газа / ел3 кислоты. [2] |
Растворение окиси азота в азотной кислоте, вероятно, сопровождается прямым восстановлением азотной кислоты до азотистой с выделением NO2, которая остается в растворе. [3]
После растворения окиси цинка добавляют NaOH, затем раствору дают отстояться и чистый раствор сливают в рабочую ванну. [4]
После растворения окиси магния в серной кислоте проводят определение ванадия, используя реакцию окисления аш-кислоты броматом калия. [5]
После растворения окиси цинка не должно наблюдаться металлического цинка в виде черных точек, продолжающих растворяться с выделением пузырьков водорода. [6]
После растворения окиси цинка и просветления корректирующий раствор считают готовым. [7]
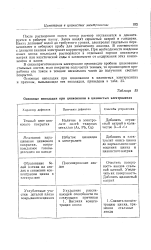 |
Основные неполадки при цинковании в цианистых электролитах. [8] |
После растворения окиси цинка раствор отстаивается и декантируется в рабочую ванну. Затем вводят сернистый натрий и глицерин. Ванну доливают водой до требуемого уровня, электролит тщательно перемешивают и отбирают пробу для химического анализа. В соответствии с данными анализа электролит корректируют. При необходимости введения окиси цинка последняя растворяется в отдельной порции цианистого натрия или каустической соды в зависимости от содержания этих компонентов в ванне. [9]
Для растворения оставшейся окиси кальция в стакан постепенно приливают 100 - 125 мл азотной кислоты, раствор отфильтровывают от угля, и осадок тщательно промывают водой, проверяя полноту отмывки раствором азотнокислого серебра. [10]
После растворения облученной окиси нептуния в ЮМ HNO3 к раствору добавляют сульфамат железа для переведения нептуния и плутония в четырехвалентное состояние. [11]
Степень растворения окиси алюминия в этих электролитах при формовке возрастает с увеличением концентрации и температуры растворов. [12]
Механизм растворения окиси скандия, имеющей кубическую структуру типа Мп2Оз, в сложном окисле Ca3UO6 с ромбически искаженной структурой типа криолита, столь отличной от Mn2O3, на первый взгляд кажется необъяснимым. [13]
Степень растворения окиси алюминия в этих электролитах возрастает при формовке с увеличением концентрации и температуры раствора. [14]
Получают растворением окиси или карбоната железа, или металлического железа в соляной кислоте или в царской водке, а также пропусканием газообразного хлора над раскаленным докрасна железом. Безводный продукт представляет собой расплывающуюся на воздухе водорастворимую массу желтого, коричневого или гранатового цвета. Гидратированный продукт ( с пятью или двенадцатью молекулами воды) представляет собой оранжевые, красные или пурпурные кристаллы. [15]
Страницы: 1 2 3 4