Растворение - ртуть
Cтраница 2
Восстанавливается непосредственно при потенциале растворения ртути. [16]
Щелочность раствора влияет на скорость растворения ртути примерно так же, как и на скорость растворения благородных металлов: при высокой щелочности растворение ртути заметно замедляется, что свидетельствует не только о снижении окислительного потенциала кислорода, но и об усилении кинетических осложнений при восстановлении кислорода на поверхности ртути. [17]
Азотнокислая закисная ртуть HgN03 получается растворением ртути в небольшом количестве азотной кислоты. Растворение ведется сначала на холоду, а затем при нагревании. Кристаллизационную воду легко теряет при долгом хранении или нагревании до 70; с НС1 и NaCl дает белые осадки HgCl. В разбавленных растворах гидролизуется в кислую соль, остающуюся в растворе, и основную соль, выпадающую в осадок. [18]
Определение микропримесей металлов основано на растворении ртути в азотной кислоте, селективном восстановлении ее до металлической муравьиной кислотой [1] с последующим спектральным анализом водной фазы. Возбуждение спектров проводят в дуге переменного тока в присутствии хлористого натрия. [19]
Сульфат Hg2S04 может быть получен или растворением ртути в концентрированной серной кислоте или добавлением разбавленной серной кислоты к раствору нитрата закиси ртути. Труднорастворим в воде, гидролизуется с образованием основных солей. [20]
Нитрат ртути ( I) получают растворением ртути в разбавленной азотной кислоте в условиях избытка металла. [21]
В присутствии сульфатов бария и стронция после растворения ртути остается осадок белого цвета. Если барий и стронций отсутствуют, осадок растворится полностью. [22]
Этот диапазон потенциалов ограничивается при положительных потенциалах растворением ртути, а при отрицательных - электровосстановлением катионов щелочных металлов из основного электролита или выделением газообразного водорода. [23]
Нитрат ртути Hg ( NO3) 2 получают растворением ртути в избытке азотной кислоты с последующим упариванием раствора. [24]
Если поляризовать такой электрод до положительных потенциалов, то происходит растворение ртути. [25]
Гремучая, ртуть ( ртутная соль гремучей кислоты) образуется растворением ртути в азотной кислоте, с последующим прибавлением к полученному раствору спирта. Гремучая ртуть отделяется при этом в виде желтоватых кристаллов, которые промываются холодной водой. Образовавшийся маточный раствор, содержащий взрывчатые вещества и кислые промывные воды, собирается в ямах, футерованных кислото - и теплостойким материалом. К маточному раствору периодически прибавляют известковое молоко и нагревают острым паром в течение 30 мин. [26]
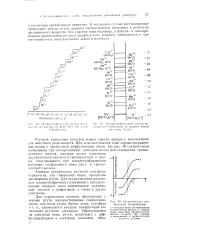 |
Полярографический спектр по.| Схематическое изображение полярограмм. [27] |
Анодная поляризация ртутного электрода ограничена, как говорилось выше, процессом растворения ртути. Для осуществления различных полярографических измерений с использованием анодных волн применяются платиновый, золотой и графитовый, а также и другие электроды. [28]
Символ f обозначает, что данный деполяризатор восстанавливается непосредственно при потенциале растворения ртути. [29]
Иногда титрование необходимо проводить при очень положительных потенциалах, где уже происходит растворение ртути. [30]
Страницы: 1 2 3 4