Растворение - соединение
Cтраница 2
Из измеренных теплот растворения соединений и известных из литературы предельных теплот растворения галогенидов калия и кадмия [23] были рассчитаны изменения энтальпии при образования соединений из компонентов. [16]
Как было показано, растворение соединений, распадающихся на ионы, увеличивает упорядоченность растворителя. [17]
Жидкие мембраны получают обычно растворением жидкого ионообменного соединения в несмешивающемся с водой растворителе. В отличие от твердых ионообменных соединений, ионогенные группы которых фиксированы в матрице мембраны, в жидких ионообменных соединениях ионогенные группы подвижны. В последние годы количественной характеристике поведения жидких мембран посвящены работы Конти, Эйзенмана, Сандблома и Уокера [96 - 101 ], в которых рассмотрена проблема возникновения электрических потенциалов на мембранах в условиях равенства нулю приложенной извне разности потенциалов. [18]
Образование окрашенных растворов при растворении соединений, подобных трифенилметанолу, в серной кислоте и аналогичное солям поведение, например трифенилметилхлорида в растворе диоксида серы, послужило основой химии карбениевых ионов, ко торая была заложена в начале XX века главным образом работами Байера, Гомберга, Вальдена и Ганча. Для обозначения образующихся при этом частиц Байер использовал термин карбоний, имея в виду аналогию таких частиц с другими ониевыми ионами, однако этот термин был подвергнут критике Гомбергом, который предложил называть соли таких ионов солями карбида. Термин карбениевый ион, как более логичный, был предложен Дильтеем почти 20 лет спустя, однако до 1970 г. в литературе сохранялась первоначальная номенклатура, где применялся термин карбоние-вый ион. В последнее время чрезвычайно горячо, в особенности в работах Ола, пропагандируется более рациональная схема номенклатуры карбокатионов, изложенная в разд. Это связано с возрастающим интересом к электронодефицитным частицам типа CHs стимулированным результатами экспериментальных работ в газовой фазе и суперкислых средах, а также квантово-химическими расчетами. [19]
Выше было показано, что растворение соединений, распадающихся па ионы, увеличивает упорядоченность растворителя. Это проявляется, в частности, в уменьшении диэлектрической постоянной раствора с ростом концентрации электролита. Поскольку упорядоченность появляется в результате взаимодействия между ионами электролита и частицами растворителя, она должна увеличиваться с теплотой сольвации. Энтропия характеризует степень неупорядоченности системы. Поэтому энтропия сольватации ионов всегда отрицательная; она тем больше по абсолютной величине, чем экзо-термичнее реакция сольватации. [20]
 |
Реальные энергии гидратации отдельных ионов. [21] |
Выше было показано, что растворение соединений, распадающихся на ионы, увеличивает упорядоченность растворителя. [22]
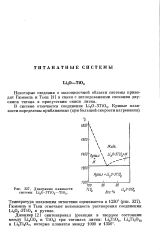 |
Диаграмма плавкости системы Li20 ЗТЮ2 - ТЮ2. [23] |
Гюммель и Тьен отмечают возможность растворения соединения Li2 ( V3Ti02 в рутиле. [24]
В ряде работ величины энтальпий растворения соединений используют для расчета АЯ / этих соединений в комбинации с АЯ реакций, протекающих в растворах. Для этого были измерены АЯ реакции железа с раствором НС1 и АЯ растворения хлорного железа в соляной кислоте таким образом, что конечные состояния растворов были идентичными. [25]
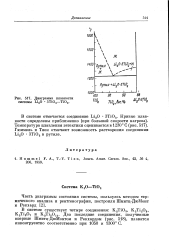 |
Диаграмма плавкости системы Li2O ЗТЮ2 - ТЮ2. [26] |
Гюммель и Тиен отмечают возможность растворения соединения LiaO ЗТЮ2 в рутиле. [27]
Обменная реакция обратима: при растворении тяжелого соединения в обыкновенной воде часть ее водородных атомов обменивается местами с атомами дейтерия растворенного вещества. [28]
Обратный способ экстракции твердых смесей - растворение соединений макрокомпонентов с оставлением соединения микрокомпонента в нерастворенном состоянии - следует рассматривать как ненадежный метод вследствие большой потери микрокомпонента за счет растворимости, если даже абсолютйое значение ее чрезвычайно мало. [29]
Термореагентный метод основан на интенсификации процесса растворения кольматирующих соединений путем использования разогретого раствора, поступающего в водоприемную часть скважины. При соля-нокислотной обработке в качестве термореагента ( вещество, взаимодействующее с химическим реагентом с выделением тепла) обычно используется металлический магний. [30]
Страницы: 1 2 3 4