Растворение - соль
Cтраница 2
Растворение солей в воде уменьшает парциальное давление водяных паров и соответственно влагосодержание газа. Мак-Кетта и Катц получили поправочный коэффициент / Са, равный отношению влагосодержания природного газа плотностью р 0 73 кг / м3, находящегося в контакте с рассолом, к влагосодер-жанию газа, находящегося в контакте с чистой водой. [16]
Растворение солей в воде и жидкой фазе буровых растворов возрастает с повышением температуры и давления. Количество соли в растворе пропорционально времени контакта с ним соли; растворимость солевых пород минимальна при полном насыщении ( для данных температур) жидкой фазы растворов теми же солями. Растворение солей ведет к образованию каверн радиусом до 3 - 4 м и более, недоподъему цементного раствора, потере устойчивости колонны, ее изгибу или обрыву. Для предотвращения растворения солей тампонажный раствор затворяют водными растворами тех же солей. Моделирование условий реальных скважин, где цементный камень находится в постоянном контакте с обладающими неограниченной реакционной емкостью твердой солевой породой или ее насыщенным раствором, требует применения для затворения цемента насыщенных или близких к насыщению концентрированных растворов солей. [17]
Растворение соли при циркуляционном выщелачивании по самой природе физико-химических процессов протекает сравнительно медленно. [18]
Растворение солей производят в реакторе, куда загружают четыреххлористое олово, сернокислые соли кобальта, алюминия и магния и добавляют воду из расчета получения 8 - 10 % раствора. [19]
Растворение соли в режиме свободной конвекции имеет место в подземных солевых камерах, а также в наземных емкостях, заполненных солью и водой и не имеющих мешалок или других средств перемешивания. [20]
Растворение соли в воде сопровождается медленным выделением водорода; растворы же в жидком аммиаке вполне стойки. [21]
Растворение соли в газовой фазе приводит к тому, что могут возникнуть критические состояния жидкость-газ в системах, в состав которых входят вода и соль, т.е. жидкая и газовая фазы в этих системах могут стать идентичными. [22]
Растворение солей и газов. В насыщенном и перегретом паре могут растворяться соли, имеющиеся в котловой воде. Наибольшим коэффициентом растворимости обладает кремниевая кислота, вынос которой уже при давлении 40 - 60 кгс / см2 становится вполне заметным. [23]
Растворение солей обычно сопровождается выделением или поглощением тепла. Поэтому следует ожидать, что в процессе растворения температура кристаллов будет отличаться от температуры растворителя. Разница в температурах должна быть наиболее значительной при замедленных явлениях теплопередачи и сравнительно больших тепловых эффектах растворения. [24]
Растворение солей производят в реакторе, куда загружают четыреххлористое олово, сернокислые соли кобальта, алюминия и магния и добавляют воду из расчета получения 8 - 10 % раствора. [25]
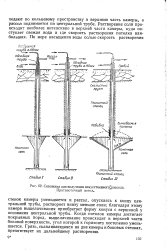 |
Скважина для получения искусственного рассола. Противоточный метод. [26] |
Растворение соли происходит наиболее интенсивно в верхней части камеры, куда поступает свежая вода и где скорость растворения потолка наибольшая. [27]
Растворение солей, адсорбция и ионный обмен имеют место и при проникновении воды в глубь почвы. Длительность взаимодействия воды с почвой, контакт с подстилающими породами и фильтрация через грунты обусловливают особенности состава, присущие подземным водам. [28]
Растворение солей с отрицательным тепловым эффектом указывает на значительную энергию разрушения кристаллических решеток. [29]
Растворение солей, как правило, сопровождается выделением тепла, если они способны вступать в химическое взаимодействие с растворителями и образуют сольваты ( гидраты - при растворении в воде); так, например, растворяются в воде хлористый кальций, йодистый барий, сульфаты натрия и меди и др. Соли же, не дающие при растворении сольватов ( гидратов), а, также сами сольваты ( гидраты) растворяются с поглощением тепла. [30]
Страницы: 1 2 3 4