Растворение - труднорастворимая соль
Cтраница 1
 |
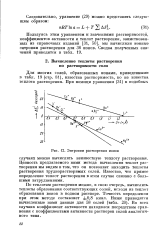
Растворение труднорастворимых электролитов при 20 С. [1] |
Растворение труднорастворимой соли всегда сопровождается конверсией ее в другую, растворимую соль. Навстречу им из секции 2 через анионитовую мембрану к аноду мигрируют нитратные ионы. В результате в секции 3 образуются растворы нитратов катионов труднорастворимых солей. Растворение электродиализом сопровождается также концентрированием раствора, так как концентрация ионов труднорастворимой соли ограничена ее растворимостью, а в секции 3 может образовываться нитрат любой концентрации в зависимости от времени растворения и приложенного потенциала, если к тому же последний не меньше равновесного. [2]
Для растворения труднорастворимых солей часто пользуются реакциями комплексообразования. [3]
В аналитической химии часто проводится растворение труднорастворимых солей путем перевода в комплексное соединение. Равновесие между насыщенным раствором твердой соли и твердой фазой смещается при изменении концентрации одного из ионов. Равновесие восстанавливается только за счет растворения труднорастворимой соли. [4]
 |
Энтропии растворения ионов. [5] |
Ценность предлагаемого нами метода вычисления теплот растворения мы видим в том, что он позволяет находить теплоты растворения труднорастворимых солей. Известно, что прямое определение теплот растворения в этом случае связано с большими затруднениями. [6]
 |
Термодинамические характеристики процесса. [7] |
В связи с этим для расчета теплоты образования безводного фосфата празеодима нами был использован метод, основанный на определении теплоты растворения труднорастворимой соли. [8]
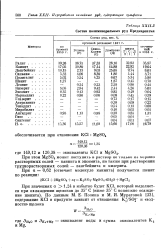 |
Состав полиминеральных руд Продкарпатья. [9] |
При этом MgS04 может поступить в раствор не только л а хорошо растворимых солей - каинита и эпсомита, но также при растворении труднорастворимых солей - лангбейнита и кизерита. [10]
Если определение растворимости труднорастворимых соединений проводят при трех-четырех температурах, то дальнейший расчет проводится графически. Полученное значение дифференциальной теплоты растворения труднорастворимой соли используется для дальнейших термодинамических расчетов. [11]
Окислы азота могут образовывать с серной кислотой труднолетучие соединения, которые легче удалять из водного раствора, поэтому после озоления в пробу добавляют один или два раза по 40 - 50 мл дистиллированной воды и продолжают кипячение. После полного удаления окислов азота в охлажденную до комнатной температуры пробу добавляют около 50 мл дистиллированной воды и нагревают до кипения для растворения труднорастворимых солей. Горячий раствор фильтруют через фильтр Шотта № 3 с принудительным отсосом воздуха. Фильтр промывают двумя-тремя порциями горячей воды. Фильтрат и промывные воды переносят в мерную колбу на 100 мл, охлаждают, доливают водой до метки и перемешивают. [12]
В аналитической химии часто проводится растворение труднорастворимых солей путем перевода в комплексное соединение. Равновесие между насыщенным раствором твердой соли и твердой фазой смещается при изменении концентрации одного из ионов. Равновесие восстанавливается только за счет растворения труднорастворимой соли. [13]
 |
Зависимость активности ионов в почве ( in sHu ( / и в почвенной. [14] |
Между жидкой, твердой и газообразными фазами почвы существует динамическое адсорбционное равновесие, поэтому состав и концентрация почвенного раствора очень изменчивы. Применение потенциомет-рического метода с ионоселективными электродами для исследования динамики почвенных процессов является весьма перспективным. В суточном цикле по мере повышения температуры жизнедеятельность высших растений и микроорганизмов значительно активизируется, следствием чего является обогащение жидкой фазы углекислотой и органическими кислотами. При этом рН снижается, а содержание ионов Са2 в почвенном растворе увеличивается за счет вытеснения поглощенных ионов и растворения труднорастворимых солей. [15]
Страницы: 1