Растворение - водород
Cтраница 1
Растворение водорода и других двухатомных газов в металлах сопровождается диссоциацией молекулы на поверхности. [1]
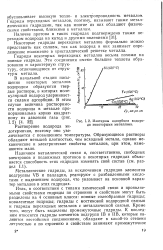 |
Изотермы адсорбции водорода некоторыми металлами. [2] |
Растворение водорода эн-дотермично, поэтому оно увеличивается с повышением температуры. Образующиеся растворы обладают меньшей плотностью, чем исходный металл, однако механические и электрические свойства металлов, при этом, изменяются мало. [3]
Растворение водорода в ниобии во многих отношениях напоминает растворение его в палладии ( в частности, при температуре выше 600 С для них выполняется зависимость растворимости от У рнг) - При определенной температуре и концентрации водорода однофазный объемноцентрированный кубический твердый раствор превращается в двухфазный твердый раствор, в котором а - и р-фазы имеют почти одинаковую кристаллическую структуру, но различаются содержанием водорода. [4]
 |
Установка Сивертса для гидрирования металлов. [5] |
Растворение водорода в металлах может происходить с образованием твердых растворов ( физическое растворение) и с образованием соединений, обладающих более или менее стехиометрическими соотношениями. Физическое растворение является процессом эндотермическим, следовательно, растворимость увеличивается с температурой. Растворимость в твердом и жидком состоянии, как правило, различна, поэтому в этом месте наблюдается скачок растворимости. [6]
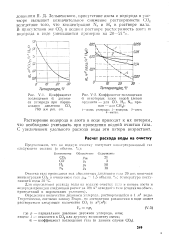 |
Коэффициент поглощения а двуокиси углерода при парциальном давлении СО., 760 мм р / п. ст.| Коэффициент поглощения а некоторых газов водой ( левая ордината - для СО, Н., N, правая - для СН4. [7] |
Растворение водорода и азота в воде приводит к их потерям, что необходимо учитывать при проведении водной очистки газа. С увеличением удельного расхода воды эти потери возрастают. [8]
Растворение водорода вызывает искажение кристаллической решетки металла и уменьшает силы межатомного взаимодействия. При критической концентрации водорода возможны потери когезивной связи между атомами в кристаллической решетке. Критическая концентрация разная для различных уровней напряженного состояния в конкретном локальном объеме: она тем меньше, чем выше уровень напряжений. Важную роль в ускорении разрушения играет трехосное напряженное состояние, ограничивающее возможность пластической деформации металла. При критической концентрации водорода или большей трещина растет; при меньшей - растрескивания нет. [9]
Растворение водорода в металле при дуговой сварке и связанная с этим пористость шва зависят также от рода сварочного тока. [10]
Растворение водорода в металле и вызываемое им вредное действие ( особенно на больших глубинах, когда возрастает парциальное давление газа) не позволяют использовать известные ранее способы автоматической и полуавтоматической сварки под водой. Использование окислительного газа, каким является СОа, обеспечивает снижение содержания водорода в результате образования в дуговом разряде нерастворимых в металле соединений гидроксила и паров воды. Опыты, проведенные в ЦНИИТМаше по сварке стали Ст. [11]
Растворение водорода в жидкости во всех случаях условно не учитывалось. [12]
Растворение водорода в указанных металлах сначала сопровождается образованием твердых р-ров с сохранением структуры металла и увеличением размеров его элементарной ячейки, дальнейшее повышение содержания водорода вызывает изменение структуры, связанное с образованием гидридных фаз, к-рых может быть несколько. [13]
Растворение водорода происходит либо в атомарном виде, либо в виде протонов. Наличие в газовой фазе молекулярного водорода перед его растворением требует диссоциации его на атомы, например в дуге или при соударении молекул с поверхностью твердого или жидкого растворителя. [14]
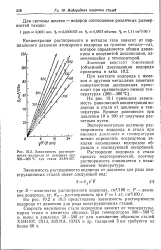 |
Зависимость растворимости водорода от давления при 300 - 900 С для стали Х18Н10Т. [15] |
Страницы: 1 2 3 4