Анодное растворение - кадмий
Cтраница 1
Анодное растворение кадмия изучено на кадмиевом и кадмие-во-амальгамном электродах. [1]
Установлено [4], что поляризация при анодном растворении кадмия, олова и сплавов кадмия и олова, содержащих 25 и 50 % Sn, различна. Растворение кадмия протекает при значительно более отрицательных значениях потенциала, чем анодное растворение олова. При плотности тока 0 4 а / дм анодное растворение кадмия и олова протекает без пассивации металлов. Характер анодной поляризации значительно меняется с изменением концентрации бор-фтористоводородной кислоты в электролите. При содержании в электролите 27 Г / л HBF4 анодное растворение сплава Cd-Sn, содержащего 25 % олова, происходит с преимущественным переходом в электролит кадмия. Для перехода в электролит обоих компонентов сплава необходимо увеличение концентрации борфтористоводород-ной кислоты. [2]
Построив поляризационную кривую, полученную при анодном растворении кадмия в присутствии добавки CdSCU, в координатах Е - lg /, можно убедиться в том, что линейная зависимость между Е и lg / отсутствует. [3]
В случае отсутствия солей кадмия применяют способ анодного растворения кадмия. Для этого сначала приготовляют по рецепту раствор цианистого натрия, переливают его через фильтр в рабочую ванну и разбавляют холодной водой до рабочего уровня. Затем завешивают в ванну кадмиевые аноды. В качестве катодов берут стальные прутки, помещенные в глиняные пористые сосуды, наполненные 5 / 6-ным раствором едкого натра. [4]
Характер влияния концентрации соли на величину энергии активации при катодном выделении цинка аналогичен наблюдаемому при анодном растворении кадмия. Подобная же аналогия имеет место у анодного растворения цинка и катодного выделения кадмия. Указанная аналогия сочетается с зеркальным различием згказанных зависимостей. [5]
Определяют тангенс угла наклона линейного участка зависимости Е - lg / и делают заключение о природе медленного процесса при анодном растворении кадмия. [6]
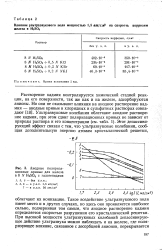 |
Анодные поляризационные. кривые для железа в 8 N Нг5О4 с галогенидами. [7] |
Такое воздействие ультразвукового поля имеет место и в других случаях, но здесь оно проявляется наиболее сильно, подчеркивая тем самым, что анодное растворение кадмия определяется скоростью разрушения его кристаллической решетки. [8]
Если объемный окисел Cd ( OH) 2, выпадая из раствора в результате гидролиза комплексного аниона кадмия, не будет создавать на поверхности металла плотного изолирующего слоя, то анодное растворение кадмия в щелочи должно было бы происходить до полного механического разрушения электрода. Однако в действительности, судя по кривым зависимости потенциала от количества прошедшего электричества, растворение кадмия происходит с постоянной скоростью и при постоянном потенциале лишь до определенного предела, зависящего от концентрации щелочи и плотности тока. Затем наступает резкая пассивация электрода, не связанная с какими бы то ни было нарушениями механической прочности электрода. Очевидно, в процессе анодной поляризации, наряду с растворением кадмия, на поверхности электрода происходят изменения, в результате которых в некоторый критический момент прекращается дальнейший процесс анодного растворения. Такими изменениями могут быть образование пассивирующего слоя в результате накопления гидроокиси на поверхности металла или в результате образования поверхностного окисла. [9]
Ионизация атомов кадмия и разряд его гидратированных ионов или сульфатных комплексов протекают на кадмиевом электроде с большой скоростью. Поэтому скорость анодного растворения кадмия ( или его амальгамы) в сульфатных и других сходных электролитах определяется скоростью процесса диффузии ионов кадмия от поверхности электрода в толщу раствора и зависит от гидродинамических условий и концентрации ионов кадмия в растворе. [10]
Установлено [4], что поляризация при анодном растворении кадмия, олова и сплавов кадмия и олова, содержащих 25 и 50 % Sn, различна. Растворение кадмия протекает при значительно более отрицательных значениях потенциала, чем анодное растворение олова. При плотности тока 0 4 а / дм анодное растворение кадмия и олова протекает без пассивации металлов. Характер анодной поляризации значительно меняется с изменением концентрации бор-фтористоводородной кислоты в электролите. При содержании в электролите 27 Г / л HBF4 анодное растворение сплава Cd-Sn, содержащего 25 % олова, происходит с преимущественным переходом в электролит кадмия. Для перехода в электролит обоих компонентов сплава необходимо увеличение концентрации борфтористоводород-ной кислоты. [11]
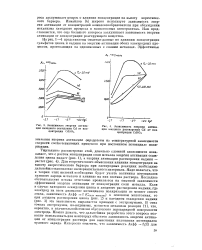 |
Зависимость энергии активации катодного осаждения Gd от концентрации GdS04.| Зависимость энергии активации анодного растворения Cd от концентрации CdSO. [12] |
Для теоретического объяснения влияния концентрации на высоту энергетического барьера при электродных реакциях необходимо дальнейшее накопление экспериментального материала. Надо полагать, что в теории этих явлений необходимо будет учесть величины потенциалов нулевого заряда металлов и влияние на них состава раствора. Последнее обстоятельство весьма отчетливо проявляется на опытной зависимости эффективной энергии активации от концентрации соли металла. Если в случае катодного осаждения цинка и анодного растворения кадмия, где электрод на всем диапазоне потенциалов поляризации не меняет своего знака, зависимость Аэфф f ( Ссоль металла) в основном монотонная, то при анодном растворении цинка ( рис. 2) и катодном осаждении кадмия ( рис. 3) эта зависимость выражается кривыми с экстремумами. В - этих точках экстремумов, по-видимому, меняется механизм реакции [1], что, вероятно, в значительной степени обусловлено перезарядкой поверхности электрода. Можно думать, что дальнейшая разработка этого вопроса - позволит использовать для некоторых объектов зависимость энергии активации от концентрации раствора для выяснения положения потенциалов нулевого заряда. [13]
Страницы: 1