Анодное растворение - феррохром
Cтраница 1
 |
Кусковой феррохромовый анод.| Литой анод до электролиза ( слева и поело частичного растворения ( справа. [1] |
Анодное растворение феррохрома наиболее целесообразно вести на режиме образования бихроматов, когда аноды остаются блестящими и не обволакиваются осадками. При работе на таком режиме в качестве исходного электролита в ванну заливается оборотная промывная вода, содержащая бихромат, а добавление щелочи производится непрерывно малыми порциями. [2]
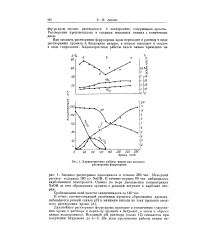 |
Характеристика работы ванны для анодного растворения феррохрома. [3] |
При анодном растворении феррохрома хром переходит в раствор в вид & растворимых хромата и бихромата натрия, а железо выпадает в осадок в виде гидроокиси. [4]
Электрохимический способ получения Na2Cr2O7 анодным растворением феррохрома в щелочных ( NaOH или Na2CO3) и хро-матных растворах изучен в АН ГрузССР [ 17, стр. [5]
Опыты проводили на растворах, полученных методом анодного растворения феррохрома, а также на предварительно очищенных от железа растворах бихромата кальция. [6]
Как видно из сказанного, способ получения бихро-мата натрия анодным растворением феррохрома очень прост и лишен многих недостатков, свойственных химическому способу. [7]
Принципиальная технологическая схема процесса приведена на рис. 8.15. Ниже даются характеристики процесса анодного растворения феррохрома. [8]
Одним из перспективных способов получения квасцов является электролитический способ. В основе его лежит анодное растворение феррохрома ( рис. 43), Растворение производят в ваннах с анодами, отлитыми из феррохрома, и с железными катодами. Электролитом служат обычно промывные воды от промывки железного шлама, получающегося при растворении анодов. [9]
Исходным материалом для приготовления электролита являются хромоаммонийные квасцы Cr2 ( SO4) 3 ( NH4) 2SO4 - 24H2O, дающие растворы ионов хрома фиолетовой модификации. Они получаются восстановлением хроматных щелоков, которые в свою очередь гото1вятся посредством анодного растворения феррохрома. [10]
На 1 т СгО3 расходовали: 750 кг феррохрома ( 65 - 69 % хрома), 180 кг H2SO4, 100кг угля. Ва ( ОН) 2 ( дающей в качестве отхода бланфикс), 4000 кВт - ч электроэнергии и 12 чел. В СССР получение СгО3 анодным растворением феррохрома в сернокислых растворах исследовано в работе [ 319, стр. [11]
Хром может быть получен либо электролизом хромовой кислоты, либо электролизом хромоаммонийных квасцов. Процесс ведут при плотности тока 3000 - 10000 А / м2 и 25 - 35 С. Катодный выход по току составляет 20 - 35 %, считая на Сг ( VI), а расход электроэнергии 40000 - 70000 кВт - ч / т хрома при напряжении на ванне 5 - 8 В. Процесс ведут в прямоугольных электролизерах без диафрагмы, футерованных свинцом или фторопластом. Более экономичен процесс получения из хромоаммонийкых квасцов. Их получают анодным растворением феррохрома. Получение хрома производят в электролизере с диафрагмой. В этих условиях катодный выход по току составляет 40 - 50 % на Сг ( III), напряжение на ванне 4 - 4 5 В, а расход электроэнергии 18 000 - 20 000 кВт - ч / т хрома. [12]
Страницы: 1