Анодное растворение - хром
Cтраница 1
Анодное растворение хрома во многих растворах при высоких i происходит в состоянии транспассивации. Поляризационные кривые, полученные в растворах Na2SO4 и NaCl в аналогичных условиях, имеют такой же вид. Хром в этих условиях переходит в раствор, накапливается там, в основном, в виде соединений шестивалентного металла 2Сг 7Н2О - - Сг2О72 - 4 - 14Н 12е и происходит подкисление не только прианод-ного слоя электролита, но и общего объема проработанного электролита. При ЭХРО сталей, например на никелевой основе - содержащих некоторое количество хрома, общий объем проработанного электролита немного подщелачивается так, что железо, никель и некоторые другие металлы образуют осадок гидроксильных соединений. В результате этого электролит становится токсичным и требует специальных мер предосторожности. [1]
Накапливающиеся в прикатодном слое продукты анодного растворения хрома в известной степени способны уменьшить диффузионные ограничения при катодной поляризации, что позволяет повысить допустимую плотность тока. [2]
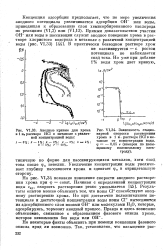
На рис. VI34 показано изменение скорости анодного растворения хрома при ф const. Результаты опытов можно объяснить тем, что ионы С1 - способствуют анодному растворению хрома. Но при достаточно положительном потенциале и достаточной концентрации воды ионы С1 - вытесняются из адсорбционного слоя ионами ОН или молекулами Н2О, которые, адсорбируясь, тормозят анодный процесс. [4]
В кулонометрическом титровании используются химические реакции различных типов: кислотно-основные, окислительно-восстановительные, комплексообразования и др. Различные восстановители [ Fe11, Sn11, Sbin, As111 и др. ] могут быть оттитрованы, например, перманганатом, который легко генерируется из Мп8С4 в ячейке с платиновым анодом. При анодном растворении хрома в серной кислоте получается дихромат-ион, который также может быть использован для этого титрования. В кулонометрическом титровании широко применяют также, например, свободный бром, генерируемый на платиновом аноде из хлороводородного раствора бромида калия. [5]
При хромировании применяют нерастворимые аноды, так как использование для этой цели хрома невозможно по трем причинам. Главная из них - легкость анодного растворения хрома: анодный выход по току превышает катодный примерно в & раз. [6]
При хромировании применяют нерастворимые аноды, так как использование для этой цели хрома невозможно по трем причинам. Главная из них - легкость анодного растворения хрома: анодный выход по току превышает катодный примерно в 8 раз. [7]
При хромировании применяют нерастворимые аноды -, так как использование для этой цели хрома невозможно по трем причинам. Главная из них - легкость анодного растворения хрома: анодный выход по току превышает катодный примерно в 8 раз. [8]
Этот способ непригоден для деталей, насыщение которых водородом не допускается, например, для чугунных поршневых колец. Для таких деталей применяется способ, состоящий в анодном растворении хрома в щелочи. [9]
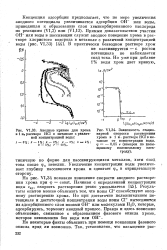
На рис. VI34 показано изменение скорости анодного растворения хрома при ф const. Результаты опытов можно объяснить тем, что ионы С1 - способствуют анодному растворению хрома. Но при достаточно положительном потенциале и достаточной концентрации воды ионы С1 - вытесняются из адсорбционного слоя ионами ОН или молекулами Н2О, которые, адсорбируясь, тормозят анодный процесс. [11]
Электролиз в растворах хромовой кислоты осуществляется с нерастворимыми анодами. Применение растворимых хромовых анодов невозможно ввиду того, что анодный выход хрома по току в 6 - 8 раз выше катодного. Кроме того, при анодном растворении хрома в раствор наряду с шестивалентным хромом переходит трехвалентный. Благодаря этому в электролите непрерывно возрастает общая концентрация хрома и накапливаются значительные количества трехвалентных его соединений, что нарушает нормальное течение электролиза. [12]
Страницы: 1