Растворимость - иодид - серебро
Cтраница 1
Растворимость иодида серебра значительно возросла в присутствии 1 М раствора аммиака. Однако рассчитанная величина показывает, что Agl, практически полностью остается в осадке. [1]
Произведение растворимости иодида серебра является весьма малой величиной: ПРдд. Поэтому, несмотря на ничтожно малую концентрацию ионов Ag в растворе, при добавлении KI произведение концентраций ионов [ Ag ] и [ I - ] превышает величину произведения растворимости Agl, вследствие чего и выпадает осадок иодида серебра. [2]
Так как растворимость иодида серебра в одних и тех же условиях значительно меньше, чем растворимость бромида и хлорида серебра, то при титровании вначале выпадает иодид, затем бромид серебра, имеющий среднюю величину ПР, и, наконец, наиболее растворимый хлорид серебра. На обычной потенциометрической кривой получается три перегиба - волны, а на дифференциальной кривой - три максимума, соответствующие точкам эквивалентности титрования иодидов бромидов и хлоридов. [3]
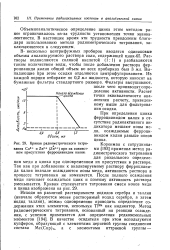 |
Кривая радиометрического титро. [4] |
Исходя из различий растворимости иодидов серебра и таллия ( вначале образуется менее растворимый иодид серебра, а затем иодид таллия), можно одновременно проводить определение со-держация этих элементов, используя Т1204 как индикатор. [5]
Следовательно, произведение концентраций ионов серебра и иода в растворе значительно больше, чем произведение растворимости иодида серебра Agl. Значит, осадок иодида серебра выпадет и комплекс К [ Ag ( CN) 21 разрушится. [6]
Следовательно, произведение концентраций ионов серебра и иода в растворе значительно больше, чем произведение растворимости иодида серебра Agl. Значит, осадок иодида серебра выпадет и комплекс KlAg ( CN) 2 ] разрушится. [7]
Серебро можно титровать в присутствии РЬ и Т1, так как они не восстанавливаются при потенциале меркур-иодидного электрода, а растворимость иодида серебра меньше растворимости иодидов свинца и таллия, вследствие чего в осадок выпадает в первую очередь AgJ. Свинец и таллий мешают определению серебра только тогда, когда содержание ихв растворе в несколько десятков раз больше содержания серебра. [8]
Некоторые из этих комплексов очень устойчивы; устойчивость ци-анидного комплексного иона серебра Ag ( CN) 2, например, настолько велика, что добавление иодид-иона не вызывает осаждения иодида серебра, хотя произведение растворимости иодида серебра очень мало. Ионы гексацианоферрата ( П) Ре ( СМ) Г, гексацианоферрата ( Ш) Fe ( CN) i - H гексацианокобальтата ( 1П) Co ( CN) - настолько устойчивы, что они почти не разрушаются под действием сильной кислоты. [9]
Некоторые из этих комплексов очень устойчивы; устойчивость цианид-ного комплексного иона серебра Ag ( CN) i, например, настолько велика, что добавление иодид-иона не вызывает осаждения иодида серебра, хотя произведение растворимости иодида серебра очень мало. Ионы гекса-цианоферрата ( П) Fe ( CN) e -, гексацианоферрата ( Ш) Fe ( CN) и гексациано-кобальтата ( Ш) Co ( CN) i - настолько устойчивы, что они почти не разрушаются под действием сильной кислоты. [10]
Для определения серебра было предложено в основном два реактива - хлорид и иодид ( калия или натрия), образующие, как известно, малорастворимые осадки с серебром. Так как растворимость иодида серебра составляет 1 2 - 10 - 8AJ при 25 С, а растворимость хлорида серебра в тысячу раз больше ( 1 2 10 - 5М), то предпочтение следует отдать иодиду калия. Ниже приводится несколько вариантов определения серебра иодидом калия, наиболее удобных с практической точки зрения. [11]
Для определения серебра было предложено в основном два реактива - хлорид и иодид ( калия или натрия), образующие, как известно, малорастворимые осадки с серебром. Так как растворимость иодида серебра составляет 1 2 10 - 8 М при 25 С, a растворимость хлорида серебра в тысячу раз больше ( 1 2 10 - 5М), то предпочтение следует отдать иодиду калия. Ниже приводится несколько вариантов определения серебра иодидом калия, наиболее удобных с практической точки зрения. [12]
Селеноцианат серебра очень мало растворим в воде. Его произведение растворимости величина приблизительно такого же порядка, как и произведение растворимости иодида серебра. Эта соль образует довольно устойчивые суспензии, но в присутствии избытка ионов серебра она разлагается с образованием металлического серебра. [13]
Он показал, что синильная кислота ( е 113 при 22 С) является значительно худшим растворителем для электролитов, чем вода. Фреденхаген также отмечал, что в жидком аммиаке, который образует весьма стабильные комплексы с ионами серебра, растворимость иодида серебра очень велика; растворимость бромида и хлорида меньше, а фторид серебра является труднорастворимым веществом. В воде, которая сильно сольватирует малые анионы, но слабее аммиака сольватирует ионы серебра, порядок изменения растворимости становится противоположным: фторид - серебра является растворимой солью, а другие галогениды - труднорастворимыми, причем растворимость уменьшается в ряду: хлорид, бромид, иодид. [14]
Избыток растворимого иодида удерживает иодид серебра в коллоидном состоянии, пока не будет достигнута точка эквивалентности, и лишь тогда начинает коагулировать твердая фаза. При некоторых условиях осадок может адсорбировать иодид-ионы, вследствие чего просветление наступает несколько преждевременно. Однако при сильном взбалтывании и большем разбавлении можно получить хорошие результаты1 ( ср. Поскольку растворимость иодида серебра исключительно мала ( около 0 0025 мг в 1 л), насыщенный его раствор не образует осадка ни при добавлении ионов серебра, ни при добавлении иодид-ионов. [15]
Страницы: 1 2