Растворимость - монокальцийфосфат
Cтраница 1
Растворимость монокальцийфосфата, уменьшается по мере понижения температуры и повышения концентрации Р2О5 в системе, что приводит к повышению выхода фтора. [1]
Растворимость монокальцийфосфата уменьшается по мере понижения температуры и повышения концентрации Р2О5 в системе, что приводит к повышению выхода фтора. [2]
С повышением температуры растворимость монокальцийфосфата возрастает, растворимость дикальцийфосфата уменьшается. [3]
При повышении температуры растворимость монокальцийфосфата уменьшается, а дика льцийфрсф эта увеличивается. [4]
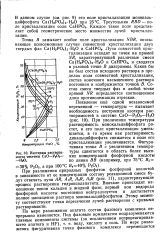 |
Изотермы растворимости системы СаО - PjOs. [5] |
При увеличении температуры растворимость монокальцийфосфата растет, и его поле кристаллизации уменьшается, в то время как растворимость дикальцийфосфата снижается и поле его кристаллизации увеличивается. [6]
Увеличение содержания HNO3 в растворе также приводит к возрастанию растворимости монокальцийфосфата. [7]
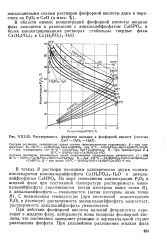 |
Растворимость фосфатов кальция в фосфорной кислоте ( система. [8] |
С повышением температуры ( при постоянной концентрации Р2С5 в растворе) растворимость монокальцийфосфата возрастает, растворимость дикальцийфосфата уменьшается. [9]
 |
Изотерма растворимости в системе СаО - Р2О6 - Н2О при 80 С. [10] |
Степень разложения зависит от относительного количества соли и воды. Поэтому о растворимости монокальцийфосфата можно говорить лишь условно. Постоянным является только то количество воды, которое необходимо для перевода определенного количества соли в раствор при данной температуре. [11]
Степень разложения зависит от относительного количества соли и воды. Поэтому о растворимости монокальцийфосфата можно говорить лишь условно - Постоянным является только то количество воды, которое необходимо для перевода определенного количества соли в раствор при данной температуре. [12]
В области очень разбавленных растворов в твердой фазе появляются еще более основные фосфаты. С повышением температуры растворимость монокальцийфосфата в фосфорной кислоте возрастает, дикальцийфосфата - уменьшается. [13]
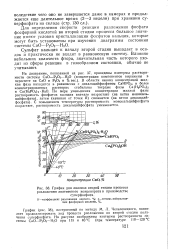 |
График для анализа второй стадии процесса. [14] |
На диаграмме, показанной на рис. 37, приведены изотермы растворимости системы СаО - P2Os - H20 ( концентрации компонентов выражены в пересчете на СаО и P2Os в % вес. В области низких концентраций жидкая фаза находится в равновесии с дикальцийфосфатом CaHPO. С повышением температуры растворимость монокальцийфосфата возрастает, растворимость дикальцийфосфата уменьшается. [15]
Страницы: 1 2