Растворимость - натрий
Cтраница 2
Из литературы [3-7] известны только данные по растворимости натрия в расплавленном хлориде натрия. Какие-либо сведения о влиянии активности натрия в металлической фазе на равновесную концентрацию его в расплаве NaCl неизвестны. [16]
Для повышения выхода по току необходимо максимально снизить растворимость натрия в электролите и ускорить удаление образующейся воды из анолита. [17]
Для повышения выхода по току необходимо максимально снизить растворимость натрия в электролите и ускорить удаление образующейся воды из ано-лита. [18]
Исключение составляет натрий, который из-за высокой величины перенапряжения водорода на ртути, а также из-за сравнительно неплохой растворимости натрия в ртути ( образование амальгамы) может быть выделен электролизом из водного раствора в том случае, если катодом служит ртуть. [19]
С увеличением растворимости натрия уменьшается выход по току. Растворимость натрия в электролите зависит: 1) от температуры электролита; 2) от величины поверхностей катода и натрия, плавающего в сборнике металла; 3) от примесей в электролите. [20]
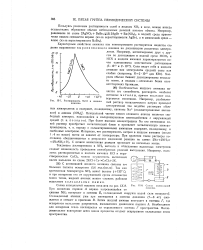 |
Растворимость NaCl в жидком аммиаке. [21] |
Особенностью жидкого аммиака является его способность растворять наиболее активные металлы, причем последние подвергаются ионизации. Интересно, что растворимость натрия в жидком аммиаке ( около 1: 4 по массе) почти не зависит от температуры. С цезием аналогичная реакция протекает за несколько минут. [22]
С повышением температуры увеличивается испарение воды с поверхности электролизера, что сокращает количество натрия, взаимодействующего с водой. Однако таким приемом следует пользоваться ограниченно, так как при повышении температуры увеличивается растворимость натрия. [23]
С повышением температуры увеличивается испарение воды с поверхности, электролизера, что сокращает количество натрия, взаимодействующего с водой. Однако таким приемом следует пользоваться ограниченно, так как при повышении температуры увеличивается растворимость натрия. [24]
С повышением температуры увеличивается испарение воды с поверхности электролизера, что сокращает количество натрия, вступающего во взаимодействие с водой с образованием NaOH. Однако таким приемом следует пользоваться ограниченно, так как с повышением температуры увеличивается растворимость натрия. [25]
Чтобы увеличить выход по току, нужно иметь электролизер правильной конструкции и соблюдать точный технологический режим электролиза. Конструкция ванны и режим процесса должны быть таковы, чтобы обеспечить главным образом понижение растворимости натрия в католите и максимальное удаление воды из анолита. Так как совершенно исключить растворение натрия и воды в электролите нельзя, то необходимо добиться такого обмена катодного и анодного расплава, чтобы обеспечить протекание реакции их взаимодействия преимущественно в катодном пространстве. Если реакция ( 23) будет происходить у анода, где по реакции ( 22) образуется и кислород, то в ванне при электролизе будут происходить частые и сильные взрывы гремучей смеси. [26]
На рис. 20 показаны некоторые типичные кривые растворимости различных солей в воде; концентрации выражены здесь через количество г безводного соединения в 100 г воды. На рис. 20 а хлористый натрий служит хорошим примером такой соли, растворимость которой с повышением температуры повышается только в незначительной степени, в то время как растворимость натрия довольно быстро увеличивается. [27]
Величина выхода натрия по току зависит от потерь металла, выделенного в процессе электролиза. Эти потери прежде всего определяются растворимостью натрия в электролите и условиями взаимодействия растворенного металла с хлором. При постоянной температуре потери возрастают с ростом содержания натрия в сплаве и, ввиду отсутствия равновесия в системе сплав - расплав из-за наличия окислителей ( прежде всего, хлора), зависят от длительности контакта сплава с расплавленной солью. [28]
Анодный выход по току несколько выше, чем катодный, поэтому раствор постепенно обогащается оловом. Кроме того, под влиянием углекислоты воздуха в электролите повышается содержание углекислого натрия. При накоплении до 5 % Na2COa растворимость оловяннокислого натрия понижается и выпадает осадок оловянной кислоты. [29]
В то же время эти соединения не должны участвовать в электролизе во избежание загрязнения полученных натрия и хлора другими веществами. Добавляемые соли не должны вместе с тем резко увеличивать растворимость натрия в расплаве и снижать электропроводность электролита. С этой точки зрения пригодны только соли кальция, калия, бария и натрия. Соединения стронция, лития, рубидия и цезия из-за высокой стоимости не могут иметь практического значения. Такие соединения как сульфаты, карбонаты, нитраты и гидроокиси, содержащие кислород, изменяют анодный процесс, поэтому не могут применяться в качестве добавок. Бромиды и иодиды также влияют на анодный процесс. [30]
Страницы: 1 2 3