Растворимость - нитрат - кальций
Cтраница 1
Растворимость нитрата кальция, являющегося одним из компонентов азотнокислотной вытяжки, значительно уменьшается при пониженных температурах. Это свойство используют для удаления избытка кальция из реакционной системы. Охлаждая азотнофосфорнокислотный раствор до минус 5 - 10 С и отделяя выкристаллизовывающийся Ca ( NO3) 2 - 4H2O, можно удалить примерно до 85 % кальция от введенного с исходным фосфатным сырьем ( см. разд. [1]
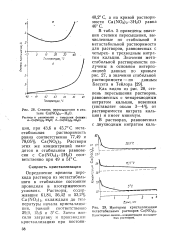 |
Степень пересыщения в системе Ca ( NO3 2 - Н2О.| Изотермы кристаллизации метастабиль ных растворов Ca ( NO3 2. [2] |
Как видно из рис. 28, степень пересыщения растворов, равновесных с четырехводным нитратом кальция, невелика ( составляет около 3 - 4 % от растворимости нитрата кальция) и имеет минимум. [3]
Растворимость нитрата кальция в фосфорнокислых растворах уменьшается с понижением температуры. Это дает возможность выводить часть ионов кальция из азотнокислотной вытяжки путем ее охлаждения. Наличие небольших количеств свободной азотной кислоты в фосфорнокислых растворах оказывает высаливающее действие на нитрат кальция. [4]
Существует ряд способов повышения в растворе мольного отношения Н3РО4: Ca ( NO3h - Одним из них является вымораживание нитрата кальция. В основе этого способа лежит уменьшение растворимости нитрата кальция при охлаждении азотно-фосфорнокислотного раствора. Выпадающую в осадок соль отделяют центрифугированием или фильтрованием, а остающийся раствор направляют на последующую переработку. [5]
Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 С отвечает липни MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему Р2О5 приводит к уменьшению растворимости нитрата кальция. Отсюда следует, что в пределах концентраций от 0 до 29 2 % Р2О5 при 50 образуется раствор фосфорной кислоты, насыщенный дигидратом нитрата кальция. Соответственно при 25 в пределах концентраций от О до 36 1 % Р2О5 образуется раствор фосфорной кислоты, насыщенный четырехводным нитратом кальция. [6]
Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 отвечает линии MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему Р2Оз приводит к уменьшению растворимости нитрата кальция. Отсюда следует, что в пределах концентраций от 0 до 29 2 % Р2О5 при 50 образуется раствор фосфорной кислоты, насыщенный дигидратом нитрата кальция. Соответственно при 25 в пределах концентрации от 0 до 36 1 % Р2О5 образуется раствор фосфорной кислоты, насыщенный четырехводным нитратом кальция. [7]
Степень выделения нитрата кальция из раствора можно увеличить на 5 - 10 % при возвращении в цикл некоторого количества маточного раствора, который, являясь более концентрированной фосфорной кислотой, чем первоначальная вытяжка, действует как высаливающий агент. Высаливающее действие этого раствора более эффективно при низких температурах ( например, - 10), а при температурах выше нуля практически не проявляется. Это связано с изменением растворимости нитрата кальция в системе СаО - Р205 - N205 - H20 в зависимости от концентрации Р205 и температуры. [8]
Степень выделения нитрата кальция из раствора можно увеличить на 5 - 10 % при возвращении в цикл некоторого количества маточного раствора, который, являясь более концентрированной фосфорной кислотой, чем первоначальная вытяжка, действует как высаливающий агент. Высаливающее действие этого раствора более эффективно при низких температурах ( например, - 10), а при температурах выше нуля практически не проявляется. Это связано с изменением растворимости нитрата кальция в системе СаО - Р205 - N206 - H20 в зависимости от концентрации Р205 и температуры. [9]
Прокаленные осадки оксалата кальция первоначально использовали для определения стронция и затем вводили поправку для получения истинного содержания кальция. Однако химических методов разделения не существует и значения для кальция с поправкой, по-видимому, почти всегда так же ошибочны, как и без нее. Наиболее часто используемый метод отделения основан на растворимости нитрата кальция в концентрированной азотной кислоте. Нитрат стронция относительно нерастворим, и его можно отфильтровать на пористый стеклянный или кварцевый тигель и взвесить. Вместо этого теперь пользуются методами фотометрии пламени и атомной абсорбции, которые не требуют трудоемкой стадии отделения. [10]
В рассматриваемой системе изотермы характеризуются полями ( насыщения моно - дикальцийфосфатом, а также водным и безводным нитрато. Эти твердые фазы образуются не только в результате высаливания одних компонентов другими, но и в результате различных химических реакций - разложения фосфатов водой, взаимодействия между нитратом кальция и фосфорной кислотой, а также между фосфатами и азотной кислотой. Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 отвечает линии MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему P2Os приводит к уменьшению растворимости нитрата кальция. [11]
Страницы: 1