Растворимость - бикарбонат
Cтраница 1
Растворимость бикарбонатов зависит от наличия в воде углекислого газа, количество которого прямо пропорционально его парциальному давлению над раствором. При высоких парциальных давлениях углекислого газа в воде может содержаться значительное количество бикарбонатов. Снижение давления вызывает выделение углекислого газа, что в свою очередь может привести к выпадению осадков. [1]
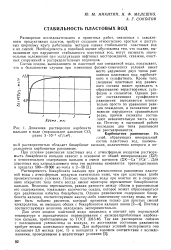 |
Динамика растворения карбоната. [2] |
Растворимость бикарбоната кальция при углекислотном равновесии пластовой воды с атмосферным воздухом значительно ниже, чем при пластовых ( либо промежуточных) условиях. Поэтому пластовые воды при очистке их в сооружениях открытого типа почти всегда имеют некоторое пересыщение бикарбонатом кальция Величина пересыщения, равная разности между общим и равновесным его содержанием, показывает количество осадка, которое может образовываться при разложении избытка бикарбоната. Поэтому соответствующая величина находилась экспериментально. [3]
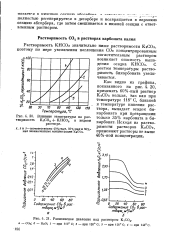 |
Влияние температуры на растворимость KaCOj KHGO3 в водном растворе.| Равновесное давление над раствором КгС03. а - СО2. б - И2О. 1 - при 110 С. г - при 120 С. 3 - при 130 С. 4, - при 140 С. [4] |
С ростом температуры растворимость бикарбоната увеличивается. [5]
При этой темп ературе растворимость бикарбоната достаточно велика, что исключает возмож - t ность выпадения последнего в виде осадка и засорения скруббе-1 ра. [6]
Чем выше температура, тем выше растворимость бикарбоната ( КНС03) в растворе, и следовательно, можно применять более концентрированный раствор, чем обеспечивается большая емкость раствора по кислым газам. [7]
Изотермы растворимости состоят из двух ветвей растворимости безводных бикарбонатов калия и натрия. [8]
Присутствие в промывной воде ионов натрия, одноименных с NaHCO3, уменьшает растворимость бикарбоната. Поэтому использование для промывки бикарбоната слабой жидкости, содержащей NaaCO3 и NaHC03, снижает потери. Не допускается присутствие в промывной воде солей жесткости, так как образующиеся при этом СаС08 и Mg ( OH) 2 быстро выводят из строя фильтрующую ткань. [9]
Присутствие в промывной воде ионов натрия, одноименных с NaHCOg, уменьшает растворимость бикарбоната. Поэтому использование для промывки бикарбоната слабой жидкости, содержащей Na2C03 и NaHCOg, снижает потери. Не допускается присутствие в промывной воде солей жесткости, так как образующиеся при этом СаСОд и Mg ( OH) 2 быстро выводят из строя фильтрующую ткань. [10]
Карбонат кальция СаС03 содержит ионы Са2 и С032 -, Он почти не растворяется в воде, тогда как растворимость бикарбоната кальция значительна ( в 1 л воды растворяется. [11]
Карбонат - и бикарбонат-ионы содержатся в пределах растворимости кальциевых и магниевых солей, а ионы Са2 - в пределах растворимости бикарбоната и сульфата. [12]
Опытным путем установлено, что с понижением температуры суспензии бикарбоната натрия в конце процесса карбонизации, а также при увеличении концентрации бикарбоната аммония в растворе степень использования натрия повышается, но только до определенной величины, зависящей от растворимости бикарбоната аммония. [13]
В процессе карбонизации жидкость разогревается до 60 - 70 в результате выделения тепла при протекании химических реакций. Для того чтобы снизить растворимость бикарбоната и получить более высокую степень использования натрия, карбонизуе-мую жидкость охлаждают в нижней части колонны. [14]
С повышением температуры константа увеличивается и скорость кристаллизации возрастает, но только при одинаковых пересыщениях. Так как с ростом температур растворимость бикарбоната тоже увеличивается, эффект может оказаться совсем иным. Дело в том, что увеличение растворимости приводит к снижению пересыщения. Поэтому рост температуры, с одной стороны, приводит к ускорению фазообразования, а с другой - к его замедлению. [15]
Страницы: 1 2