Растворимость - олово
Cтраница 4
Значительно более низкие величины для растворимости олова, полученные методом микроструктурного анализа в работе [4], могут быть обусловлены недостаточной надежностью этого метода для таких мягких сплавов, какими являются богатые индием сплавы этой системы. [46]
ЛГЛ / 13 ajIIOM HJieB ro покрытия показал, что оно содержит 0 3 вес % олова. По литературным данным [17], в связи с незнГчи тельной растворимостью олова в алюминии в твердом состоянии Ие ТаиКОИ небольшой добавки олова не отражается на физических свойствах алюминия. [47]
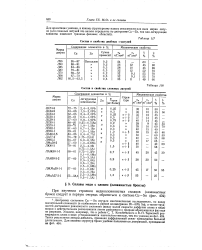 |
Состав и свойства двойных а-латуней. [48] |
Диаграмму состояния Си - Sn изучали многочисленные исследователи, но ввиду значительной сложности ( в особенности в районе концентрации 20 - 50 % Sn), а также трудностей достижения равновесного состояния ( ввиду малой скорости диффузии олова в меди) вопрос о действительном расположении линии равновесия и природе образующихся фаз еще не разрешен. Укажем, например, что в работе С. Т. Конобеевского и В. П. Тарасовой растворимость олова в меди устанавливается значительно меньше, чем это указано на фиг. Таких результатов авторы добились, применяя диффузионный отжиг чрезвычайно большой длительности. [49]
Наибольшее практическое значение имеют сплавы, содержащие до 20 % Sn. Эта часть диаграммы состояния Си-Sn представляет собой - твердый раствор олова в меди, имеющий гранецентри-рованную кристаллическую решетку. Растворимость олова в меди меняется от 15 8 % при 586 С до 1 % при 200 С. [50]
Наибольшее практическое значение имеют сплавы, содержащие до 20 % Sn. Эта часть диаграммы состояния Си-Sn представляет собой а-твердый раствор олова в меди, имеющий гранецентрн-рованную кристаллическую решетку. Растворимость олова в меди меняется от 15 8 % при 586 С до 1 % при 200 С. [51]
Диаграмма состояния системы Аи - Sn была впервые разработана [1] по результатам исследований, выполненных методами термического и микроструктурного анализов. По данным этой работы в системе существуют три химических соединения, одно из которых - AuSn ( 37 57 % Sn) плавится конгруэнтно при 418, а два других - AuSna ( 54 62 % Sn) и AuSn4 ( 70 65 % Sn) образуются по перитектическим реакциям при 309 и 252 соответственно. Надежных определений растворимости олова в твердом золоте в этом исследовании сделано не было. Sn при медленном охлаждении из расплава кристаллизуется почти однофазным. [52]
В этом случае ток идет к олову. Оно переходит в раствор в виде двухвалентного иона, в то время как на другом электроде разряжается водород. Способностью олова разряжать ноны Н объясняется растворимость олова в кислотах. Однако вследствие незначительного отличия его нормального потенциала от нормального водородного потенциала олово обладает лишь весьма слабой тенденцией к растворению. [53]
В этом случае ток идет к олову. Оно переходит в раствор в виде двухвалентного иона, в то время как на другом электроде разряжается водород. Способностью олова разряжать ионы Н объясняется растворимость олова в кислотах. Однако вследствие незначительного отличия его нормального потенциала от нормального водородного потенциала олово обладает лишь весьма слабой тенденцией к растворению. Поэтому оно обычно заметно взаимодействует только с такими кислотами, которые, как НС1, могут увеличить эту тенденцию за счет комплексообразования. [54]
В этом случае ток идет к олову. Оно переходит в раствор в виде двухвалентного иона, в то время как на другом электроде разряжается водород. Способностью олова разряжать ионы Н объясняется растворимость олова в кислотах. Однако вследствие незначительного отличия его нормального потенциала от нормального водородного потенциала олово обладает лишь весьма слабой тенденцией к растворению. Поэтому оно обычно заметно взаимодействует только с такими кислотами, которые, как НС1Г могут увеличить эту тенденцию за счет комплексообразования. [55]
Кристаллизация сплавов, расположенных левее точки Elt начинается с выпадения твердого раствора олова в магнии. Ниже линии LE структура сплавов состоит из кристаллов твердого раствора олова в магнии и эвтектики. В кристаллах твердого раствора вследствие уменьшения растворимости олова при снижении температуры наблюдаются включения олова. [56]
На рис. 18.5, б представлена диаграмма состояния системы германий - свинец. Термодинамические расчеты показывают, что температура плавления эвтектики в сплавах германий - свинец на 0 8 К меньше температуры плавления чистого свинца, а содержание германия в эвтектике составляет 0 1 % ( ат. Растворимость свинца в германии имеет тот же порядок, что и растворимость олова в германии. [57]
Цирконий с оловом дает три химических соединения: Zr4Sn ( 24 6 вес. Sn), плавящееся конгруетно при 1985; ZrSn2 ( 72 2 вес. Растворимость олова в р-цирконии составляет при эвтектической температуре 21 вес. Растворимость олова в a - цирконии уменьшается с 9 вес. Согласно этой диаграмме цирконий с медью образуют пять химических соединений; четыре из них плавятся с открытым максимумом: Zr2Cu ( 28 83 вес. Си) при 1100, пятое образуется при температуре 1070 по перитектической реакции L ZrCu34fcZr2Cus ( 63 52 вес. Цирконий образует эвтектику с Zr2Cu при 995 и 21 вес. Кроме того, в системе имеются эвтектики Zr2Cu ZrCu, ZrCu Zr2Cii3, Zr2Cu3 Zr2Cu5 и ZrCu3 Cu. Растворимость меди в р-цирконии составляет 3 8 вес. Растворимость меди в a - цирконии не превышает 0 18 вес. [58]
Интересно отметить, что элементы подгруппы германия образуют эвтектические смеси между собой, причем Sn и РЬ растворимы в германии крайне незначительно и на макродиаграмме состояния области растворимости не отражены. Вообще для исследования ничтожно малой растворимости второго компонента и ее зависимости от температуры необходимо строить микродиаграммы. На рис. 46 для примера приводится микродиаграмма системы Ge-Си со стороны германия. Растворимость свинца в олове ограничена ( 1 45 ат. Напротив, растворимость олова в свинце довольно значительна ( 29 ат. Особенности взаимной растворимости определяются довольно заметным различием металлохимических свойств германия, с одной стороны, олова со свинцом - с другой, и нарастанием металличности связи при переходе от Sn к РЬ. [59]
Цирконий с оловом дает три химических соединения: Zr4Sn ( 24 6 вес. Sn), плавящееся конгруетно при 1985; ZrSn2 ( 72 2 вес. Растворимость олова в р-цирконии составляет при эвтектической температуре 21 вес. Растворимость олова в a - цирконии уменьшается с 9 вес. Согласно этой диаграмме цирконий с медью образуют пять химических соединений; четыре из них плавятся с открытым максимумом: Zr2Cu ( 28 83 вес. Си) при 1100, пятое образуется при температуре 1070 по перитектической реакции L ZrCu34fcZr2Cus ( 63 52 вес. Цирконий образует эвтектику с Zr2Cu при 995 и 21 вес. Кроме того, в системе имеются эвтектики Zr2Cu ZrCu, ZrCu Zr2Cii3, Zr2Cu3 Zr2Cu5 и ZrCu3 Cu. Растворимость меди в р-цирконии составляет 3 8 вес. Растворимость меди в a - цирконии не превышает 0 18 вес. [60]
Страницы: 1 2 3 4 5