Растворимость - большинство - вещество
Cтраница 2
Растворимость большинства веществ уменьшается, с понижением температуры, поэтому при охлаждении горячих насыщенных растворов избыток растворенного вещества обычно выделяется. Однако, если производить охлаждение Осторожно и медленно, защитив при этом раствор от возможности попадания в него частиц растворенного вещества извне, то выделения его из раствора может и не произойти. В этом случае получится раствор, содержащий значительно больше растворенного Вещества, чем его требуется для насыщения при данной температуре. Это явление было открыто и подробно изучено русским академиком Т. Е. Ловицем ( 1794 г.), который назвал такие растворы пересыщенными. В спокойном состоянии они могут годами оставаться без изменения. Но стоит только бросить в раствор кристаллик того вещества, которое в нем растворено, как тотчас же вокруг него начинают расти другие кристаллы и через короткое время весь избыток растворенного вещества выкристаллизовывается. Иногда кристаллизация начинается от простого сотрясения раствора, а также от трения стеклянной палочкой о стенки сосуда, в котором находится раствор. При кристаллизации выделяется значительное количество теплоты, так что сосуд с раствором заметно нагревается. [16]
Растворимость большинства веществ уменьшается с понижением температуры, поэтому при охлаждении горячих насыщенных растворов избыток растворенного вещества обычно выделяется. Однако, если производить охлаждение осторожно н медленно, защитив при этом раствор от возможности попадания в него частиц растворенного вещества извне, то выделения его из раствора может и не произойти. В этом случае получится раствор, содержащий значительно больше растворенного вещества, чем его требуется для насыщения при данной температуре. Это явление было открыто и подробно изучено русским академиком Т. Е. Ловицем ( 1794 г.), который назвал такие растворы пересыщенными. В спокойном состоянии они могут годами оставаться без изменения. Но стоит только бросить в раствор кристаллик того вещества, которое в нем растворено, как тотчас же вокруг него начинают расти другие кристаллы и через короткое время весь избыток растворенного вещества выкристаллизовывается. Иногда кристаллизация начинается от простого сотрясения раствора, а также от трения стеклянной палочкой о стенки сосуда, в котором находится раствор. При кристаллизации выделяется значительное количество теплоты, так что сосуд с раствором заметно нагревается. [17]
Так как растворимость большинства веществ сильно зависит от температуры, соответственно меняются и характерные для них значения произведений растворимости. Поэтому, говоря о постоянстве значения произведения растворимости данного электролита, всегда подразумевают, что оно относится к некоторой определенной температуре. [18]
Как уже отмечалось, растворимость большинства веществ уменьшается с понижением температуры. Поэтому при охлаждении горячих растворов возникает пересыщение, обусловливающее выделение кристаллов. Этот метод получил название изогидрической кристаллизации, поскольку при его осуществлении количество растворителя ( например, воды) остается постоянным. [19]
Как правило, с повышением температуры растворимость большинства веществ возрастает. Обобщение большого числа экспериментальных данных позволило поягчитъ вероятные значения растворимости f4IJ, которые обычно используются для практических расчетов. [20]
Как правило, с повышением температуры растворимость большинства веществ возрастает. Обобщение большого числа экспериментальных данных позволило поточить вероятные значения растворимости [41], которые обычно используются для практических расчетов. [21]
 |
Барабан сепаратора. [22] |
Этот процесс основан на том, что растворимость большинства веществ в тех или % иных растворителях с повышением температуры значительно возрастает. Раствор, содержащий при данной температуре максимально возможное количество растворенного вещества, называется насыщенным при данной температуре. [23]
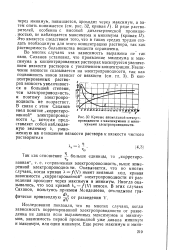 |
Кривые аномальной электропроводности с максимумами и минимумами электропроводности. [24] |
Это является следствием того, что в таких средах трудно создать необходимую для этого концентрацию раствора, так как растворимость большинства веществ ограничена. [25]
Для более полного выделения кристаллов из маточного раствора часто прибегают к его охлаждению при помощи охлаждающих смесей или же ставят сосуд с раствором в холодильный шкаф. Растворимость большинства веществ при низких температурах уменьшается, и поэтому путем охлаждения достигается большая полнота выделения кристаллизуемого вещества из раствора. Однако нужно учитывать, что понижение температуры может уменьшать скорость роста кристаллов, что особенно заметно в случае вязких жидкостей. [26]
Константы D2O отличаются от таковых для обычной воды: пл 3 8 С, 101 4 С, р 1 105 г / мл. Растворимость большинства веществ в тяжелой воде значительно меньше, чем в обычной воде. Тяжелая вода ядовита, так как замедляет биологические процессы в живых организмах. [27]
Концентрация, соответствующая насыщенному раствору, называется растворимостью данного вещества. Растворимость большинства веществ увеличивается с повышением температуры. [28]
Холодная вода отмывает только хорошо растворимые в ней загрязнения. Поскольку при нагревании растворимость большинства веществ в воде резко увеличивается, горячей водой можно вымыть посуду значительно быстрее и лучше. Для механического удаления приставших к стенкам сосуда загрязнений применяют различного рода ерши и щетки с мягкой щетиной. Нельзя чистить посуду песком, наждачной бумагой, стальной проволокой, так как на поверхности стекла при этом неизбежно образуются царапины. [29]
Для очистки твердых веществ очень часто пользуются перекристаллизацией. Для этого вещество растворяют при нагревании в возможно меньшем количестве соответствующего растворителя, быстро фильтруют и затем охлаждают раствор. Так как при понижении температуры растворимость большинства веществ уменьшается, то растворенное вещество выделяется в виде кристаллов; примеси обычно остаются в растворе, называемом маточным раствором. [30]
Страницы: 1 2 3