Растворимость - бромид
Cтраница 4
Равновесная концентрация ионов серебра известна из условия задачи. Равновесная концентрация бромид-ионов равна растворимости бромида серебра в данных условиях: [ ВГ ] S 3 03 - 10 моль / л, поскольку бромид-ионы не участвуют в побочных реакциях. [46]
Молекулы аммиака понижают концентрацию ионов серебра в растворе. В результате равновесие реакции растворения сдвигается вправо и растворимость бромида серебра увеличивается. [47]
В табл. 1 приведены полученные нами экспериментальные данные по растворимости хлорида, бромида и иодида калия в воднодиоксановых растворителях различного состава при температуре 25 С. Из таблицы видно, что в ряду KJ - КВг - КС1 растворимость солей уменьшается, причем различие в растворимости бромида и хлорида калия в несколько раз меньше по сравнению с растворимостью иодида калия. Характер уменьшения растворимости с добавлением диоксана для всех трех солей однотипен: при концентрациях неэлектролита примерно до 0 2 мольных долей наблюдается более резкое снижение растворимости. При дальнейших добавках диоксана растворимость плавно и незначительно уменьшается: в случае хлорида калия - почти до нуля, а для остальных двух солей до 1 5 ( КВг) и 3 5 ( KJ) г / моль / lOQO г растворителя. Надо отметить, что в изученных системах при температуре 25 С не происходит расслаивания компонентов. [48]
Он показал, что синильная кислота ( е 113 при 22 С) является значительно худшим растворителем для электролитов, чем вода. Фреденхаген также отмечал, что в жидком аммиаке, который образует весьма стабильные комплексы с ионами серебра, растворимость иодида серебра очень велика; растворимость бромида и хлорида меньше, а фторид серебра является труднорастворимым веществом. В воде, которая сильно сольватирует малые анионы, но слабее аммиака сольватирует ионы серебра, порядок изменения растворимости становится противоположным: фторид - серебра является растворимой солью, а другие галогениды - труднорастворимыми, причем растворимость уменьшается в ряду: хлорид, бромид, иодид. [49]
Таким образом, центрифугированием удается отделить [ Ag ( NH3) 2lCl от осадка Agl и AgBr. Поскольку, однако, ион [ Ag ( NH3) 2 ] не является очень прочным, концентрация катионов Ag в центрифугате оказывается достаточной, чтобы при введении Вг - произведение растворимости бромида серебра было превышено. [50]
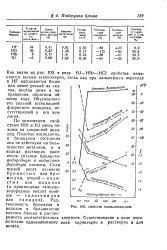 |
U. Свойства галоидоводородов. [51] |
По химическим свойствам НВг и HJ очень похожи на хлористый водород. Подобно последнему, в безводном состоянии они не действуют на большинство металлов, а в водных растворах дают очень сильные бромисто-водородную и иодистояо-дородную кислоты. Растворимость бромидов и иодидов в большинстве случаев близка к растворимости соответствующих цательно одновалентного астата. [52]
Страницы: 1 2 3 4