Растворимость - твердый раствор
Cтраница 1
Растворимость твердого раствора возрастает с повышением температуры и уменьшается с ростом концентрации ZnSO4 в жидкой фазе. [1]
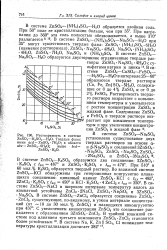 |
Растворимость в системе ZnSO4 - H2SO4 - H2O. Твердые фазы. ниже acd - ZnSO4 7Н2О. в области abc - ZnSO4 6Н2О. выше bed - ZnSO4 Н2О. [2] |
Растворимость твердого раствора возрастает с повышением температуры и уменьшается с ростом - концентрации ZnSO4 в жидкой фазе. [3]
 |
Кривые солидуса в системах Си-Zn, Си-Ga. [4] |
Граница растворимости твердых растворов в сплавах Си-Zn, Си-Ga, Си-Ge и Си-As приблизительно определяется одной и той же концентрацией электронов: 140 валентных электронов на 100 атомов, образующих бинарную систему. [5]
Если две соли в водном растворе при данной температуре образуют непрерывный ряд твердых растворов ( см. разделы 6.3 и 9.4), то диаграмма состояния такой системы будет иметь одну кривую растворимости твердого раствора ( рис. 120) с веером равномерно расходящихся лучей Схрейнемакерса, оканчивающихся на стороне АХ-ВХ треугольника составов. [7]
В системе CuSQ4 - FeSO4 - H2SO4 - Н2О в интервале 27 - 95 и диапазоне концентраций H2SO4 от 7 до 37 г / л и FeSO4 от 10 до 300 г / л твердые фазы представляют собой три типа твердых растворов ( Си, Fe) SO4 - 5H2O с содержанием FeSO4 ( в вес. С повышением температуры растворимость твердого раствора уменьшается, а содержание FeSO4 в нем возрастает. [8]
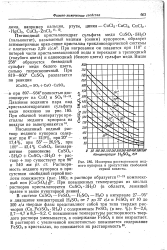 |
Изотермы растворимости медного купороса в присутствии свободной серной кислоты. [9] |
В системе CuSO4 - FeSO4 - H2SO4 - H2O в интервале 27 - 95 и диапазоне концентраций H2SO4 от 7 до 37 г / л и FeSO4 от 10 до 300 г / л твердые фазы представляют собой три типа твердых растворов ( Си, Fe) SO4 5Н2О с содержанием FeSO4 ( в вес. С повышением температуры растворимость твердого раствора уменьшается, а содержание FeSO4 в нем возрастает. [10]
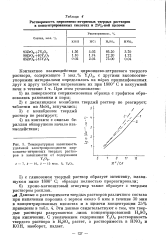 |
Температурная зависимость удельной электропроводности циркониево-иттриевых твердых растворов в зависимости от содержания. [11] |
Эти данные свидетельствуют о том, что твердые растворы разрушаются лишь концентрированной H2S04 при кипячении. С увеличением содержания Y2O3 растворимость твердого раствора в H2S04 растет, а растворимость в HN03 и КОН, наоборот, падает. [12]
 |
Зависимость константы решетки. [13] |
Если известна кривая зависимости константы решетки от состава, то можно легко определить состав сплава, используя результаты рентгенографического измерения. Этим методом часто пользуются в металлографии для определения границ растворимости твердых растворов. [14]
В системе ZnSO4 - ( NH4) 2SO4 - Н2О образуется двойная соль. В системе ZnSO4 - Na2S04 - H2O образуются двусторонние ограниченные твердые растворы ZnSO4 Na2SO4 4Н2О с сульфатами натрия и цинка и. Растворимость твердого раствора возрастает с повышением температуры и уменьшается с ростом концентрации ZnSO4 в жидкой фазе. [15]
Страницы: 1 2
