Растворимость - любое вещество
Cтраница 1
Растворимость любых веществ зависит от температуры. Обычно с повышением температуры растворимость увеличивается, а с понижением температуры - уменьшается. На рисунке 60 показана зависимость растворимости алюмокалиевых квасцов от температуры. [1]
Кривая растворимости любого вещества непрерывна до тех пор, пока твердая фаза, равновесная с раствором, остается неизменной. [2]
Анализ зависимости растворимости любого вещества в растворителях различной природы наглядно иллюстрирует влияние на растворимость природы растворителя. [3]
С помощью кривых легко определить растворимость любого вещества при любой температуре. [4]
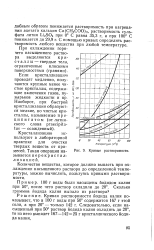 |
Кривые растворимости. [5] |
Са ( СН3СОО) 2, растворимость сульфата лития Li2SO4 при 0 С равна 35 3 г, а при 100 С понижается до 29 9 г. С помощью кривых определить растворимость любого вещества при любой температуре. [6]
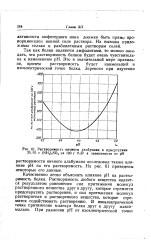 |
Растворимость яичного альбумина в присутствии 25 95 г ( NH4 2SO4 на 100 г НоО в зависимости от рН. [7] |
Качественно легко объяснить влияние рН на растворимость белка. Растворимость любого вещества является результатом равновесия сил притяжения молекул растворенного вещества друг к другу, которое стремится предотвратить растворение, и сил притяжения молекул растворителя и растворенного вещества, которое стремится содействовать растворению. В изоэлектрической точке притяжение молекул белка друг к другу максимально. [8]
При добавлении органического слоя ( например, смеси бензола с ацетоном) полного растворения слоя, содержащего Q - OH, не происходит, и реальная система, которую обычно называют двухфазной, на самом деле состоит из трех жидких фаз ( две органические и одна водная) и по крайней мере одной твердой фазы. Содержание этих компонентов может измениться в ходе реакции, однако в концентрированных водных растворах щелочей растворимость любых веществ довольно мала. [9]
Другими словами, каждой температуре отвечает определенное значение-константы равновесия реакции, подобно тому как каждой температуре соответствует определенная растворимость любого вещества. [10]
Другими словами, каждой температуре отвечает определенное значение константы равновесия реакции, подобно тому как каждой температуре соответствует определенная растворимость любого вещества. [11]
Зависимость между растворимостью вещества и температурой раствора принято изображать графически, в виде так называемых кривых растворимости. Чтобы построить такую кривую, откладывают по горизонтальной оси числовые значения температуры, а по вертикальной - числовые значения растворимости. По особенностям кривой судят, как влияет повышение температуры на растворимость данного вещества. Например, рассматривая кривые, приведенные на рис. 32, можно сказать, что растворимость нитрата калия KNO3 ( калийная селитра) с повышением температуры увеличивается быстро. Наоборот, растворимость поваренной соли NaCl повышается весьма незначительно: с 35, 8 г при 0 С до 39 2 г при 100 С. Лишь у немногих твердых веществ при повышении температуры растворимость уменьшается. Так, понижается растворимость при нагревании ацетата кальция Са ( СН3СОО) 2, растворимость сульфата лития Li2SO4 при 0 С равна 35 3 г, а при 100 С понижается до 29 9 г. С помощью кривых можно определить растворимость любого вещества при любой температуре. [12]
Страницы: 1