Растворимость - различное вещество
Cтраница 3
При изучении растворимости различных веществ в двухслойных системах, состоящих из двух практически нерастворимых жидкостей, была открыта важная закономерность, получившая название закона распределения. Сущность этого закона можно установить, рассмотрев полученные А. А. Яковкиным в 1889 г. опытные данные по распределению иода между водой и четыреххлористым углеродом. [31]
При магнитной обработке повышается растворимость различных веществ в воде, ускоряются процессы коагуляции взвесей и осветления воды. Воздействие магнитных полей на процессы кристаллизации различных веществ используется для предварительной подготовки воды перед подачей в паровые котлы. Обработка ее магнитным полем способствует уменьшению образования накипи. В нефтепромысловом деле этот эффект используется для борьбы с отложениями солей в трубопроводах при добыче обводненной нефти. [32]
При этом надо учитывать растворимости различных веществ в разных растворителях и иногда повышать или понижать растворимость, применяя различные смеси растворителей. [33]
Хотя с повышением температуры растворимость различных веществ изменяется неодинаково, имеет место и определенная закономерность. [34]
При этом надо учитывать растворимости различных веществ в разных растворителях и иногда повышать или понижать растворимость, применяя различные смеси растворителей. [35]
Таким образом, между растворимостью различных веществ в паре и энергией их кристаллической решетки должна существовать определенная функциональная зависимость, которая до сих пор, однако, количественно еще не может быть раскрыта из-за недостатка данных для соответствующих параметров. [36]
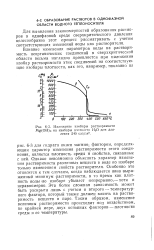 |
Наложение изобары растворимости Mg ( OH2 на изобары плотности НаО для давления 240 кгс / см. [37] |
Однако невозможно объяснить характер изменения растворимости различных веществ в воде по изобаре только изменением свойств растворителя. Особенно это относится к тем случаям, когда наблюдается явно выраженный минимум растворимости, в то время как плотность воды по изобаре убывает непрерывно - хотя и неравномерно. Эта более сложная зависимость может быть раскрыта лишь с учетом и второго - температурного фактора, который также должен влиять на растворимость веществ в паре. Таким образом, изменение величины растворимости происходит под воздействием, по крайней мере, двух основных факторов - плотности среды и ее температуры. [38]
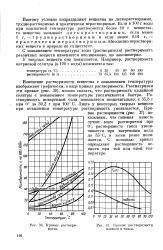 |
Кривые растворц-мости.| Кривые растворимости извести и гипса. [39] |
С повышением температуры воды ( растворителя) растворимость различных веществ изменяется неодинаково, но закономерно. [40]
Для систематизации и обобщения обширного опытного материала по растворимости различных веществ имеет большое значение гипотетическое эталонное понятие идеального или простейшего раствора, выводимое на основе принятия аддитивности его свойств. [41]
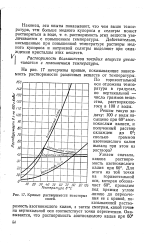 |
Кривые растворимости некоторых линию Д пересече-солей Т ния ее с кривой, по. [42] |
На рис. 17 начерчены кривые, показывающие зависимость растворимости различных веществ от температуры. [43]
Для решения многих теоретических и практических задач необходимы сведения о величинах растворимости различных веществ, в том числе и малорастворимых. В частности, данные о растворимости нужны при определении полноты осаждения соединения из раствора, выделении элемента с помощью соосаждения, построении процессов разделения с помощью переосаждения и во многих других случаях. [44]
Однако, как уже указывалось выше, мы не знаем достаточно строгих закономерностей, характеризующих растворимость различных веществ, особенно веществ органических. Поэтому во многих случаях следует пользоваться и чисто эмпирическими правилами. Так, например, по некоторым наблюдениям, чем больше атомов кислорода в молекуле, тем легче вещество растворимо в воде или спирте. Во многих случаях это положение оправдывается, несмотря на кажущееся противоречие его с приведенным выше правилом. [45]
Страницы: 1 2 3 4