Растворимость - сода
Cтраница 3
Технологическая схема отделения выпарки слабых щелоков является типовой. Для получения жидкого товарного продукта достаточно двух выпарных аппаратов. Растворимость соды и сульфата натрия соответственно уменьшается, и они выделяются в твердую фазу. Поэтому после второго корпуса едкий натр направляют на вакуум-фильтры. [31]
Технологическая схема отделения выпарки слабых щелоков является типовой. Для получения жидкого товарного продукта достаточно двух выпарных аппаратов. Растворимость соды и сульфата натрия соответственно уменьшается, и онп выделяются в твердую фазу. Поэтому после второго корпуса едкий натр направляют на вакуум-фильтры. [32]
Растворение кальцинированной соды в воде сопровождается выделением тепла и разогревом раствора. Наибольшее количество соды ( 56 г в 100 г воды) растворяется при 32 5 С. При дальнейшем повышении температуры растворимость соды понижается. [33]
В настоящее время осуществлен способ, по которому непосредственно в щелочных башнях получают более концентрированные щелока, чем указано выше. По этому способу циркулирующие щелока донасыщают содой или, в случае абсорбции известковым молоком, известью. Это возможно потому, что растворимость нитрита и нитрата натрия в воде больше растворимости соды. Отсюда следует, что полученные после поглощения окислов азота щелока очень далеки от насыщения. [34]
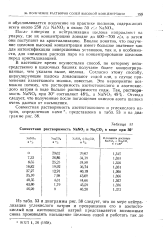 |
Совместная растворимость NaNO2 и Na2CO3 в воде при 30. [35] |
В настоящее время осуществлен способ, по которому непосредственно в щелочных башнях получают более концентрированные, чем указано выше, щелока. Согласно этому способу, циркулирующие щелока донасыщают содой или, в случае применения известкового молока, известью. Это мероприятие возможно потому, что растворимость азотистокислого и азотнокислого натрия в воде больше растворимости соды. Отсюда следует, что полученные после поглощения окислов азота щелока очень далеки от насыщения. [36]
Выпускается также специальный сорт соды - так называемая тяжелая сода. Она хорошо растворяется в воде с выделением тсл.пи. При нагревании раствора выше 32 5 С растворимость соды снижается. [37]
При переработке бокситов с повышенным содержанием серы происходит постепенное обогащение оборотных растворов сульфатом натрия. Так как сульфат натрия осложняет процесс спекания ( см. с. Для этого маточный раствор упаривают до концентрации, при которой происходит кристаллизация сульфата натрия. Растворимость сульфата натрия в алюминатно-щелочных растворах близка к растворимости соды, поэтому при упаривании выделяется содосульфатная смесь с преобладающим количеством сульфата. От маточного раствора содосульфатная смесь отделяется в результате сгущения в сгустителях и последующего центрифугирования осадка на центрифугах. [38]
Сернистый газ хотя составляет ангидрид кислоты, но, как и углекислый газ, с водою прочных соединений не образует, а дает раствор, при нагревании выделяющий весь газ. Кислотный характер сернистого ангидрида выражается ясно в том, что он поглощается вполне щелочами, с которыми дает кислые и средние соли, легко растворимые в воде. Соли сернистой кислоты вообще весьма сходны с соответственными солями угольной. Одну из наичаще приготовляемых солей, а именно кислую сернистонатровую соль NaHSO: i можно получить, пропуская сернистый газ не только в раствор едкого натра, но и в раствор соды до насыщения ( СО 2 вытесняется); так как растворимость кислой сернистонатровой соли гораздо больше растворимости соды, то после пропускания сернистого газа растворяется еще новое количество соды, и, таким образом, можно получить весьма крепкий раствор сернисто1кисло ] й соли; из него, охлаждая и испаряя ( без нагревания, потому что иначе соль выделяет SO2) или прибавляя спирта, легко получить эту соль в кристаллическом виде. Кислые сернистошелочные соли способны соединяться не только с кислородом, но и со многими другими веществами, напр. Обладая способностью притягивать кислород, NaHSO3 способна также поглощать и хлор и потому употребляется так же, как и серноватистонат-ровая соль, для удаления хлора ( как антихлор), в особенности при белении тканей, когда требуется удалить последние следы оставшегося в ткани хлора, который иначе мог бы действовать разрушительно. [39]
Технологическая схема этого метода состоит в следующем. Электролитическую щелочь упаривают до концентрации 25 - 26 % NaOH, охлаждают до 60 С и отделяют от выпавшей соли. Осадок беркеи-та отделяют затем на вакуум-фильтре с подслоем обратной соли или беркеита от предыдущей операции. Для уменьшения потерь щелочи осадок промывают небольшим количеством воды. После отделения беркеита средние щелоки направляют на дальнейшее выпаривание. По мере повышения концентрации NaOH уменьшается растворимость соды, и ее избыток, добавленный для осаждения сульфата, выпадает вместе с обратной солью. Далее сода переходит в обратный рассол и осаждает кальций при смешении сырого и обратного рассолов. Таким образом, избыток соды в процессе очистки используется почти целиком. Промытый осадок беркеита является отходом и может употребляться, например, в стекольной промышленности. [40]
Технологическая схема этого метода состоит в следующем. Электролитическую щелочь упаривают до концентрации 25 - 26 % NaOH, охлаждают до 60 С и отделяют от выпавшей соли. Осадок беркеита отделяют затем на нутч-фильтре с подслоем обратной соли или беркеита от предыдущей операции. Для уменьшения потерь щелочи осадок промывают небольшим количеством воды. После отделения беркеита средние щелока направляют на дальнейшее выпаривание. По мере повышения концентрации NaOH уменьшается растворимость соды, и ее избыток, добавленный для осаждения сульфата, выпадает вместе с обратной солью. Далее сода переходит в обратный рассол и осаждает кальций при смешении сырого и обратного рассолов. Таким образом, избыток соды в процессе очистки используется почти целиком. Промытый осадок беркеита является отходом и может употребляться, например, в стекольной промышленности. [41]
Страницы: 1 2 3