Растворимость - соединение
Cтраница 2
Растворимость соединений свинца в диапазоне рН 8 5 - 11 0 и в восстановительных условиях при рН 2 низкая - менее 1 мг / л; в интервале рН 6 - 8 растворимость элемента является сложной функцией рН, концентрации СО2 и соединений серы в воде. [16]
Растворимость соединений молибдена мало изучена. Больше всего имеется данных, касающихся окиси молибдена. Известно, что труднорастворимая окись молибдена МоО3 образует моно - и бигидраты, которые в свою очередь существуют в двух различных модификациях. [17]
Растворимость образовавшегося силикатного соединения значительно ниже растворимости силиката натрия. Более сложные алюмо - и ферроеиликатные накипи образуются в результате протекания реакций между тремя и более веществами. [18]
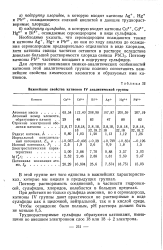 |
Важнейшие свойства катионов IV аналитической группы. [19] |
Поэтому растворимость соединений, в частности гидроокисей, сульфидов, хлоридов, колеблется в больших пределах. [20]
О растворимости соединений с одним и тем же анионом в первом приближении можно судить по поляризующей способности катиона: чем она больше, тем более ковалентные связи имеет соединение и тем растворимость их должна быть меньше. [21]
О растворимости соединений можно также судить по соотношению между энергией связи ионов в кристаллической решетке ( энергия кристаллической решетки) и энергией гидратации ( в общем случае - сольватации) ионов, которая препятствует соединению ионов в молекулу. Отношение энергии гидратации к энергии кристаллической решетки в известной мере может служить характеристикой склонности ионов к образованию осадков. [22]
На растворимость соединений влияет также соотношение радиусов ионов, образующих данное соединение. [23]
Зная растворимость соединения, вычислить растворимость его в присутствии электролита, концентрация которого известна. [24]
Поскольку растворимость соединения K2 [ ZrF6 ] в 78 % - ном растворе HF при 20 равна 36 5 г / л, а соединения H2 [ HfF6 ] - 72 г / л, эти две соли разделяют методом дробной кристаллизации. [25]
Зная растворимость соединения, вычислить растворимость его в присутствии электролита, концентрация которого известна. [26]
Пусть искомая растворимость соединения В равна х ммоль / мл после первого осаждения в растворе останется xV ммолей соли, а в осадке ( а - xVJ ммоля. [27]
Хотя растворимость индикаторного соединения нельзя количественно предсказать исходя из значения D, однако тот факт, что соединения индикатора и носителя достаточно сходны для образования изоморфных смешанных кристаллов, указывает на близость их растворимостей. Однако образование аномальных смешанных кристаллов легко принять за образование истинных смешанных кристаллов, так что приведенные выше рассуждения не всегда справедливы и могут приводить к неправильным выводам. [28]
Пусть искомая растворимость соединения В равна Ь ( ммоль / мл); после первого осаждения в растворе останется LV миллимолей соли, а в осадке ( m - LVi) миллимолей. [29]
О растворимости соединений таллия ( 1) см. разд. [30]
Страницы: 1 2 3 4