Растворимость - различная соль
Cтраница 1
Растворимость различных солей отличается как по абсолютному значению, так и по характеру зависимости ее от температуры. [1]
Значения растворимости различных солей в воде сильно отличаются друг от друга в зависимости от вида соли. Обычно растворимость увеличивается с повышением температуры, но иногда, как, например, в случае безводного сульфата кальция, с повышением температуры сверх 40 С растворимость уменьшается. Некоторые вещества, например кремниевая кислота, сильно растворимы в паре. [2]
 |
Произведения растворимости некоторых солей при 20 С. [3] |
Указанные соотношения между произведениями растворимости и растворимостью различных солей применимы лишь к однокомпонентным водным растворам. [4]
Подвижная фаза в ионообменной хроматофафии должна обеспечивать растворимость различных солей и иметь свойсгва буферного раствора, необходимые для ионного обмена, контроля степени удерживания компонентов пробы и получения достаточной селективности разделения. [5]
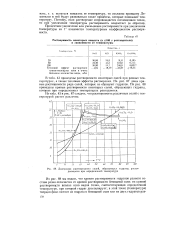 |
Диаграмма растворимости солей, образующих гидраты, распадающиеся при определенной температуре. [6] |
Из табл. 43 и рис. 87 следует, что растворимость различных солей с температурой растет различно. [7]
Величина Д5 является весьма важной для определения и понимания растворимости различных солей, и мы теперь займемся расчетом этой величины. Как можно видеть из Приложения II, Д5 равняется теплоте, поглощаемой при растворении одного моля соли с образованием гипотетического молярного раствора, деленной на Т, если процесс проведен обратимо. Но обычно Д5 получают вычислением из других термодинамических величин. [8]
Далее, намечает план сравнительного изучения некоторых свойств химических соединений, в том числе растворимости различных солей, в соответствии с расположением элементов по периодической системе. [9]
Большинство солей щелочных металлов диссоциирует в ацетонитриле частично, и это позволяет [45] рассчитать из общей и ионной растворимости различных солей константы гидратации Д ( МА) НО и Я ( МА) 2Н о растворенных недиссоциированных моно-и дигидратов. В 1 М растворах воды в ацетонитриле недиссоциированный пикрат калия, по-видимому, существует в виде общих ионных пар; другие три соли являются ионными парами, в которых гидратиро-ваны по крайней мере анионы. Что касается чистых растворителей, то вообще можно ожидать, что в протонофильных растворителях образуется больше ионных пар, чем в протонофобных апротонных растворителях, так как катионы в целом намного сильнее сольватируются первыми, чем вторыми. [10]
 |
Плотность воды и водяного пара при давлении насыщения. [11] |
Растворимость различных солей изменяется в зави симости от степени солености воды. [12]
 |
Схема растворения ионной решетки жидкостью, состоящей из полярных молекул. [13] |
Для одного и того же растворителя растворимость ионных кристаллов зависит от энергии решетки, а также от величины ионов и их большей или меньшей энергии сольватации. В табл. 11 собраны величины растворимости различных солей калия и натрия в воде. [14]
В этих работах был применен радиоактивный свинец для определения растворимости различных солей свинца ( сульфат, фторид, оксалат и др.) в различных условиях. В настоящее время как радиоактивные, так и стабильные изотопы весьма широко применяются для изучения растворимости различных соединений в воде и в неводных растворителях, для исследования процессов экстрагирования, ионного обмена, соосажде-ния и других процессов фазового разделения и распределения элементов. [15]
Страницы: 1 2