Растворимость - комплексная соль
Cтраница 1
Растворимость комплексных солей определяется, таким образом, совокупностью ряда факторов, что дает возможность использовать комплексные ионы в качестве своеобразных синтетических ионов ( или синтетических атомов по выражению Л. А. Чугаева) для получения труднорастворимых солей с самыми разнообразными внешними ионами. [1]
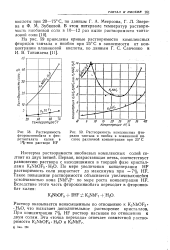 |
Растворимость комплексных фторидов тантала и ниобия в плавиковой кислоте различной концентрации при 25 С. [2] |
Изотерма растворимости ниобиевых комплексных солей состоит из двух ветвей. [3]
Кривая, отвечающая растворимости комплексной соли Na2PtCl6 - 6Н2О, обладает резко выраженным минимумом. [4]
Во многих случаях растворимость комплексных солей в различных растворителях резко отличается от растворимости исходных некомплексных соединений. [5]
Напишите выражение произведения растворимости комплексной соли K2Zn3 [ Fe ( CN) 6 ] 2, очень плохо растворимой в воде. Какие данные необходимы для вычисления концентраций ионов в насыщенном растворе этой соли. [6]
Напишите выражение произведения растворимости комплексной соли К22п3: [ Ге ( СН) б ] 2, очень плохо растворимой в воде. Какие данные необходимы для вычисления концентраций ионов в насыщенном растворе этой соли. [7]
Напишите выражение произведения растворимости комплексной соли K2Zn3 [ Fe ( CN) 6 ] 2, очень плохо растворимой в воде. Какие данные необходимы для вычисления концентраций ионов в насыщенном растворе этой соли. [8]
В связи с малой растворимостью комплексных солей концентрированные щелочные растворы UO и лимонной кислоты не могут быть получены. Разбавленные, почти бесцветные щелочные растворы в темноте устойчивы, но на свету образуют белый осадок. [9]
Увеличение размера аниона сульфокислоты вызывает понижение растворимости комплексной соли. В то время как с анионом бензолсульфокислоты ни в одном случае не образуется осадка, с толуолсульфонат-ионом осадки образуются лишь из концентрированных растворов, в случае же 3-карбазол-сульфокислоты во всех случаях наблюдается выделение осадков. Известно также, что комплексные соединения с анионом ( 3-нафталинсульфокислоты также труднорастворимы. Ализа-ринсульфонат-ион образует труднорастворимые соли с комплексными катионами, несмотря на то, что в составе этого иона имеются гидроксильные группы. [10]
Промывку следует производить, строго согласно описанию, так как именно такая промывка позволяет лучше всего отмыть комплексную соль от гомологичных пиридиновых основании с минимальными потерями за счет растворимости комплексной соли. Если исходная р-пиколиновая фракциям содержит нейтральные масла непредельного характера, то последние в условиях реакции сильно осмоляются, и комплексная соль имеет грязно-голубой цвет. Это не влияет на выход и качество 3-метилпиридина. [11]
Энергия гидратации крупных ионов невелика, поэтому такие катионы или катионные комплексы осаждаются в присутствии крупных анионов или анионных комплексов. Растворимость комплексных солей определяется совокупностью следующих факторов: отношение радиусов ионов, составляющих данную соль, должно приближаться к определенному значению ( 0 7 - 1 2); увеличение заряда комплексного иона способствует уменьшению растворимости. [12]
Из аммиакатных электролитов кадмирования применяют главным образом растворы CdO или Cd ( OH) 2 в концентрированном растворе сернокислого аммония. Образующаяся при этом комплексная соль [ Cd ( NH3) n ] SO4miH [ Cd ( NH3) n ( H2O) m ] S04 растворяется в воде значительно лучше, чем хлораммиакат кадмия [ Cd ( NH3) n ( H2O) m ] Cl2, и позволяет работать при более высоких плотностях тока. Растворимость фтористоаммиакатной комплексной соли кадмия выше, чем хлораммиакатной, но вследствие агрессивности эти растворы менее удобны в производстве. [13]
Значение комплексных соединений в анализе определяется тем, что при проявлении дополнительно-координативной валентности индивидуальность отдельных элементов выявляется значительно больше, чем при проявлении химизма, отвечающего обычной валентности. При комплексообразовании довольно часто происходит резкое изменение окраски, рН раствора, окислительно-восстановительных потенциалов, отношения к постоянному току, каталитической активности и других характерных свойств ионов. Во многих случаях растворимость комплексных солей в различных растворителях резко отличается от растворимости исходных некомплексных сое динений. [14]
Все эти факты приводят к выводу, что ионы циана являются основным фактором, способствующим упрочнению пассивирующей пленки. На основании приведенных данных трудно указать, каким путем взаимодействие металла с цианидами приводит к образованию пассивирующей пленки. Возможно, что одной из причин этого является изменение произведения растворимости комплексной соли с увеличением концентрации цианистого калия в прикатодном слое. На растворимость цианистых комплексов, очевидно, может оказывать также влияние изменения степени гидратации ионов в двойном электрическом слое и в прилегающей к нему части диффузионного слоя. [15]
Страницы: 1