Растворимость - сульфат - железо
Cтраница 1
Растворимость сульфата железа ( II) при 30 С равна 33 г безводной соли в 100 г воды. [1]
Исследована растворимость сульфата железа в растворах серной кислоты в интервале температур 50 - 95 С. [2]
Как видно из таблицы, растворимость сульфатов железа, титанг и алюминия резко снижается три повышении концентрации сернол кислоты. [3]
При нагревании травильных растворов выше 64 С растворимость сульфата железа ( II) понижается и в осадок выпадает FeSCvFbO, отделить который можно добавлением FeSO4 - 7H2O в интервале температур 65 - 85 С. [4]
При достаточно высокой плотности тока растворения металла в при-электродном слое электролита превышается произведение растворимости сульфата железа и на поверхности образуется покровный слой соли. Этот первичный слой растворяется со скоростью диффузии сульфата железа в глубь электролита. [5]
В указанных температурных пределах средний температурный коэффициент растворимости равен 0 62 г / С. Следовательно, температурная зависимость растворимости сульфата железа ceq / ( Т) аналогична наблюдаемой для сульфата меди. Близость физических характеристик растворов сульфатов железа и меди позволяет предположить, что их кристаллизация тоже характеризуется одинаковыми параметрами. [6]
 |
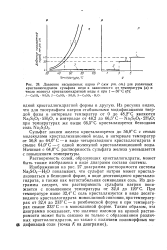
Диаграмма растворимости в системе FeSO. - Н2О. [7] |
Растворимость в воде сульфата железа ( II) с увеличением температуры от - 1 8 до 56 7 С - 40 повышается от 14 91 до 35 3 % соответственно. В водных растворах серной кислоты растворимость сульфата железа ( II) уменьшается. В системе FeSO4 - H2SO4 - Н2О при 50 С установлены стабильные области кристаллизации солей с семью, четырьмя и одной молекулами воды, а также метастабильные области гепта - и тетра-гидратов. Значительное снижение растворимости сульфата железа ( II) отмечается в концентрированной серной кислоте при высоких температурах. [8]
 |
Давление насыщенных паров Р ( мм рт. ст. для различных кристаллогидратов сульфата меди в зависимости от температуры ( а и числа молекул кристаллогидратной воды п при t 50 С ( б. [9] |
Сульфат закиси железа кристаллизуется до 56 8 С с семью молекулами кристаллизационной воды, в интервале температур от 56 8 до 64 0 С - в виде четырехводного кристаллогидрата и свыше 64 0 С-с одной молекулой кристаллизационной воды. Начиная с 64 0 С растворимость сульфата железа уменьшается с повышением температуры. [10]
С увеличением концентрации серной кислоты до 75 % растворимость соли повышается до 0 097 г на 100 г растворителя. При дальнейшем увеличении концентрации кислоты до 99 7 % растворимость сульфата железа ( III) уменьшается до 0 002 г на 100 г и в донной фазе кристаллизуется безводная соль. [11]
Подача кислоты из ванны оросительного теплообменника в концентратор автоматически регулируется в зависимости от температуры раствора, находящегося в концентраторе. В нем поддерживают концентрацию гидролизной кислоты около 55 % HzSCU, при температуре не выше 120 С. При этих условиях растворимости сульфата железа ( железного купороса) понижается, ов. Для улучшения условий кристаллизации эту пульпу непрерывно перемешивают воздушной струей-из погружной трубы эрлифта, с помощью которого пульпа транспортируется в отстойник. [12]
Растворимость в воде сульфата железа ( II) с увеличением температуры от - 1 8 до 56 7 С - 40 повышается от 14 91 до 35 3 % соответственно. В водных растворах серной кислоты растворимость сульфата железа ( II) уменьшается. В системе FeSO4 - H2SO4 - Н2О при 50 С установлены стабильные области кристаллизации солей с семью, четырьмя и одной молекулами воды, а также метастабильные области гепта - и тетра-гидратов. Значительное снижение растворимости сульфата железа ( II) отмечается в концентрированной серной кислоте при высоких температурах. [13]
Страницы: 1